一日小葵路过细胞培养室,突然听到一个声音传来“谁要能救我的细胞,我就嫁给谁。” 哇塞,这年头,不要房,不要车,只要会培养细胞就能娶到媳妇?!
为解救师妹的细胞,就得对症下药才行。一般细胞出现问题的原因可以从5个方面来着手。只要抓住这5点,救细胞就是小case。
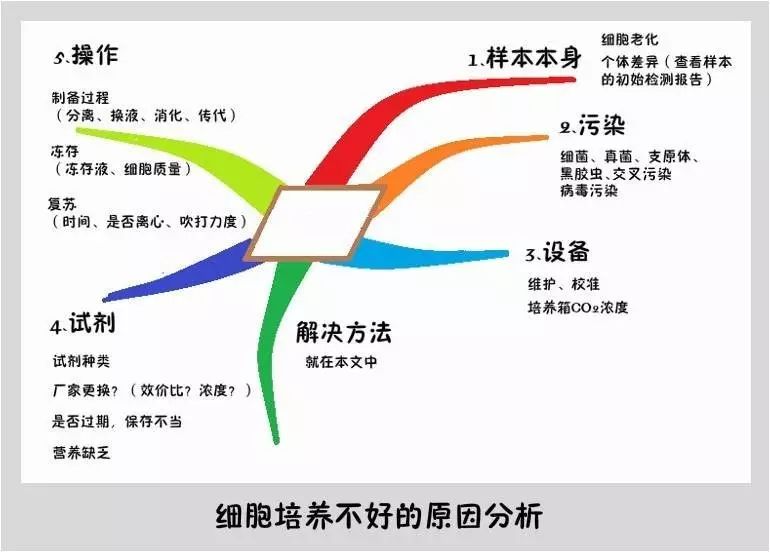
如果你拿到的细胞已经是很多代之后的了,培养的时候就会力不从心,可以重新复苏更原始的细胞进行培养。
如果你拿到的是冻存的细胞,那就有可能在冻存时该细胞的增殖能力就很弱了,可以通过查看以往的操作记录来判断。

还有一点就是个体差异,毕竟就算凤姐化再浓的妆,也不能和高圆圆长得一样。
可以在培养前通过已知的标准对样本进行筛选,从而减少个体差异带来的影响。
如果相同样本来源的其他批次的细胞并没有出现问题,你就要思考一下你是不是“中奖了”。请及时对可疑细胞以及细胞使用的试剂进行隔离。
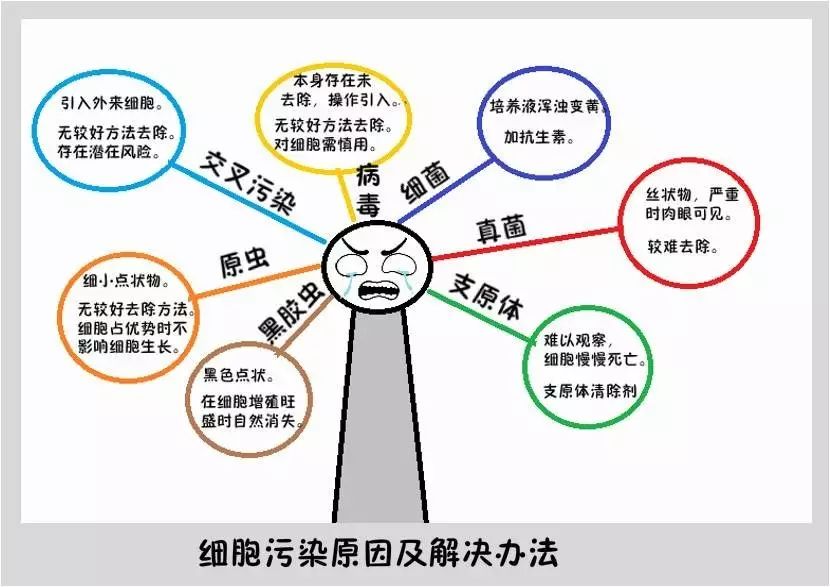
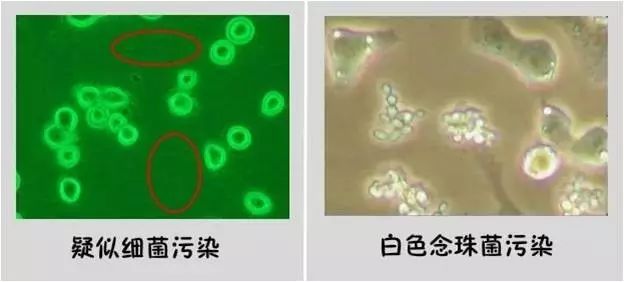
细菌污染
污染后培养液变黄并且浑浊(浑浊是关键,变黄也可能是你的细胞太密了。切勿见到黄的就以为污染。)高倍镜下观察到有小黑点会动,一般发现的时候已经是中晚期。如果细胞是上临床的还是扔了吧,别擅自处理。实验用的,可换液后补加双抗;双抗的浓度不要过大,个人用过青霉素:100IU/ml,链霉素:100ug/ml,隔1-2天换液,细胞后来好好的。
发生在细胞增殖能力旺盛期时的污染一般都能救过来,不过也有可能会影响试验数据;如果污染发生在细胞状态本身就不好的情况下就很难救活了。
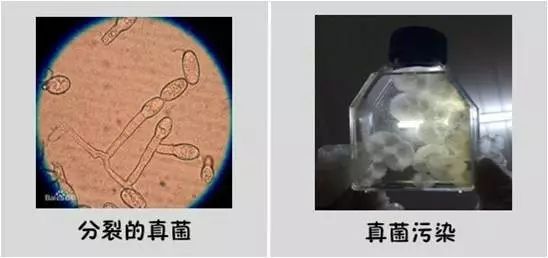
真菌污染
早期很难发现,在镜下会有丝状物,污染严重时可以用肉眼看到明显的绒团状。
真菌污染是中头奖了,你可以自拍一下留做纪念。这个时候你不仅要担心这份细胞,还要担心实验室在内的所有细胞的安危。
不建议用抗生素处理继续养。建议把所有接触到的试剂清除掉,培养箱、超净台、整个实验室都需要进行全面的消毒清洁。
支原体污染
一般劣质的血清里会带有支原体,感染后,细胞病变不明显,只是慢慢死亡。用肉眼不易发现,镜下观察背景较脏,用PCR检测最为可靠。如果细胞珍贵的话,可以用市场上的支原体清除剂去除一下。
“黑胶虫”、原虫
“黑胶虫”的存在与血清质量有关,无法过滤去除。当细胞增殖旺盛时影响不大,可换液后更换试剂,无其他特殊处理方式。
交叉污染
共用试剂、耗材,同时操作不同的样本,都极易造成交叉污染。交叉污染之王应该属于HeLa细胞了,世界上已有很多细胞都受其污染,致使许多实验宣告无效。

病毒
培养过程中,如果没有除去潜在的病毒,就会产生病毒污染。目前,从原代猴肾细胞的培养中已发现不少于20种血清性病毒。
潜在病毒是细胞大量生产疫苗、干扰素等生物制品制作中的难题。
别以为买了大公司的仪器就可以高枕无忧。有时培养箱上的显示器明明显示C02浓度为5.0%,其实际情况却可能已经<5%了。
观察细胞的培养液颜色,如果培养液偏紫红,那可能是培养箱中C02浓度不达标导致Ph偏碱,最好及时更换培养环境,重新调试培养箱。
定期对设备进行调试很重要,特别是对停机后再启动的仪器。
如果使用同批次试剂的细胞大部分都出问题了,就需要考虑是否试剂出现了问题。检查试剂的规格、效价是否与之前一致,如有改变则需修改加入的量;检查试剂的品牌是否与之前一致,如有更换应验证该品牌是否能适用于这类细胞。检查试剂的有效期是否过期、存放位置是否有问题、是否反复冻融等,以免试剂已因此而失效。

建议选定试剂后不要轻易更换试剂的品牌、规格以及供应商。对新进的试剂进行小规模的测试,测试结果达标后再大规模使用。
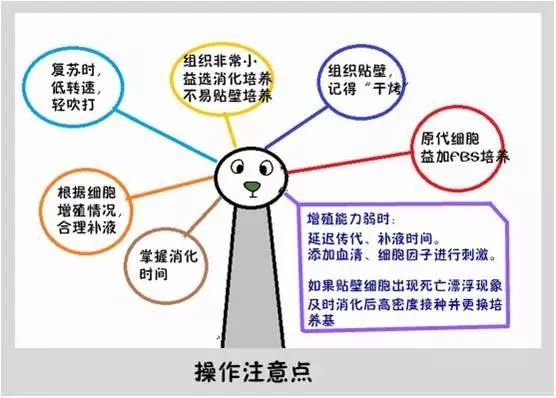
组织贴壁是否成功?
组织接种于皿后,应放于培养箱“干烤”一段时间,当组织紧贴于皿时,再加入培养基。不要频繁动皿,不益太早换液。
如果组织贴壁未做好,可以试着把飘着的组织重新接种到新皿中,重新贴壁。原代的时候还是建议加点FBS,临床上也没有严格规定不准加FBS,只要在后期检测残留量就行。
酶消化是否成功?
消化前,组织尽量剪得小点;消化液体积≥组织体积;消化时仔细观察组织的状态,一般消化快结束时组织会变得很松散,形态变模糊;消化时加点蛋白会有效地保护细胞。
使用消化酶的时候注意该组织是否需要2种及以上的消化酶同时作用?以及该消化酶是否需要其他离子来刺激?
如果酶消化后得到的细胞很少,建议在小的培养瓶中先养,待细胞增殖后再挪到大瓶中。前期也可以加点FBS。
传代时的消化?
如果你突然发现自己的细胞比以往难消化时就要小心了,这时应分段消化。把那些能正常消化下来的细胞单独培养;对那些难消化的细胞再消化一次,单独培养,并检测一下这些细胞的表型及相关特征,看是否已经发生分化或老化。
冻存环节?
当我们一次性保存20个冻存管的细胞时,如果不注意操作就会使每个管子内的细胞量差异特别大。尽量使用5mL移液管而非10mL移液管来重悬细胞,在滴加细胞悬液时尽量快点,保持细胞在每个冻存管内均匀分散。
通过在冻存管或冻存袋下放置冰块,冻存液预冷等操作使整个冻存环节保持在低温下完成。
复苏环节?
复苏后的细胞不要着急处理(换液),给予更多的时间让细胞适应。
如果你的细胞在复苏时不顺利(复苏时间过长,运输途中温度没有控制好),不要离心,直接加培养液(体积≥5倍的冻存细胞悬液体积)进行培养,离心会使原本脆弱的细胞膜破裂,待后期换液去除DMSO即可。
细胞急救秘籍今天就讲到这里。你可以先把这篇文章保存下来,当你遇到问题的时候再来看也许会更有感觉。其实很多时候,我们是不清楚到底是哪方面出现问题的,这个时候就需要一步步去排除可能原因,切勿盲目地一次性改变多个条件。
细胞培养是一个不断进步的过程,要想成为达人,看几篇文章哪够?在平时做好积累,量变才会有质变。















