
作者:子非鱼
转载请注明:解螺旋·临床医生科研成长平台
世人皆知,编码蛋白与否如一道利剑硬生生的将RNA的世界劈成两半,mRNA及非编码RNA(ncRNA)两两遥遥相望、泾渭分明。ncRNA中的小鲜肉F4(miRNA、lncRNA、circRNA、piRNA)之所以名闻天下,无外乎是依赖表观调控、转录调控、miRNA sponge、作为蛋白复合物骨架等,来行使生物学功能。
常言道,物以稀为贵。风头正盛的小鲜肉们欲要更上一层楼,牢牢霸住科研者的心,就不能只靠这些常规的技能点。对此,circRNA先是大刀阔斧劈开一个新天地,跨进了编码蛋白的世界。随后,lncRNA自然也不甘示弱,快速觉醒新技能——以短ORF(sORF)编码特定多肽,强势跨界领跑,势必要在编码蛋白的世界里分一杯羹。
不过老实港,小编在初听到lncRNA可编码多肽时,内心是拒绝的。毕竟,lncRNA的门槛不是你想跨就能跨的。一般转录本要想被lncRNA数据库登录在册,就必须要通过以下两个试炼——ORF(开放阅读框)分析和CSF分析(密码子突变率,理论上编码区的密码子相对来说是保守的,而非编码的就有点乱来了)。
这也就意味着,只有当该转录本(>200nt)不存在完整的ORF,且任性恣肆爱突变,那么它才极有可能是lncRNA。可如今,lncRNA竟凭借着sORF编码小肽的力量在编码RNA的世界中迅速崛起,又怎能不让人大吃一惊呢。
因而,现阶段一些主流期刊如Science、Cell、Molecular Cell等均争相报道此类相关现象。显然,lncRNA对小肽的编码正成为“非编码”RNA研究的新热点。



而最最重要的是,以非编码RNA编码的短肽为主题申请的基金非常少,只检索到两条!
1)长链非编码RNA-HOXB-AS3通过编码一个多肽调控PKM基因剪切抑制结肠癌发生发展的功能机制研究 2018年 面上项目 晏光荣
2)lncRNA编码的小肽在胆固醇代谢调控中的功能和作用机制 2018年 青年项目
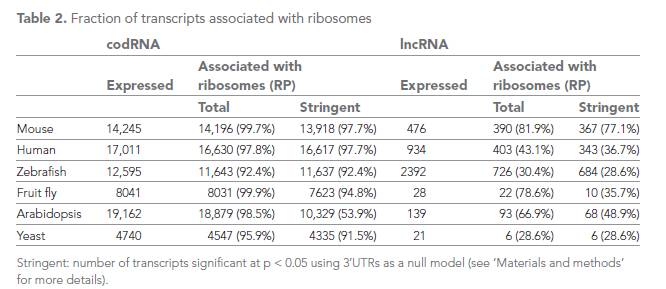
其实,2014年能编码短肽的lncRNA就已经崭露头角了,通过对脊椎动物中数百个已注释的lncRNA进行基因表达分析发现,绝大多数lncRNA至少含有一个short ORF (≥ 24amino acids)以及多个ORFs(平均43到68 amino acids)。翻译组学数据结果,所有物种> 90%的codRNA与核糖体结合;多数lncRNA能够与核糖体结合(占总lncRNA 28.6%到81.9%)

但近三年内这些小肽和sORF仍被我们华丽丽的忽视了。究其原因,是因为大多数ORF发现算法将大小临界值设为300nt(翻译100个氨基酸残基),并以此过滤掉“垃圾信息”(随机存在RNA中没有意义的ORF)。
毫无疑问,这类算法会遗漏掉那些编码小肽的sORF。显然,目前的ORF分析对于sORF的分析是不到位的,这也使得如今寻找这些编码小肽的lncRNA的努力成为一项充满挑战性的搜寻。
现阶段,通常是利用核糖体图谱(ribosome profiling)的全基因组方法,翻译所有的ORF(不论长短),而后通过针对核糖体结合RNA的下一代测序法对其进行大量评估。此方法虽然是最直观的一个方法,但着实花钱耗时费力。
而2015年Cell文章题为“A Micropeptide Encoded by a Putative Long Noncoding RNA Regulates Muscle Performance”却是先通过生物信息学的方法筛选出骨骼肌特异性编码多肽Myoregulin(MLN)的lncRNA,其次挖掘出MLN与已知功能的短肽PLN、SLN是具有序列上的保守性和相似性,并推测出MLN应也具有相似的功能。
而体外实验研究确也证明了,短肽MLN可形成单个跨膜α螺旋,与内质网膜(SR)中的 SERCA受体相互作用,抑制对钙离子再摄取。当小鼠缺失MLN基因后,增强了钙离子在骨骼肌中的处置能力并提高运动能力。种种实验结果确定了MLN是骨骼肌生理的一个重要调节因子,也证实了细胞中很多功能性微肽确是隐藏在表面上非编码的RNA中。
常言道,熟读唐诗三百首,不会作诗也会吟。看过阳春白雪(高端文章),耳闻目染,总结出一些共(tao)性(lu),保证你至少会下里巴人的玩意。显然,Cell这篇文章确实为我们研究lncRNA编码功能性微肽,提供了一个不错的模板。如何找到编码短肽MLN的lncRNA,如何确定MLN的功能,需要进行哪些实验进行佐证等等,文章中都有着细致的讲解。
但小编知道,模(tao)板(lu)这东西虽好,却是颇费脑子的。不少童鞋看完文献后依然是提笔四顾心茫然,不知身向何处行。即便手捧具有编码功能性微肽的lncRNA,却依然寻不到挖掘宝藏的大门所在,很容易就会与高分文章失之交臂,细思下来岂不是很可惜。















