至少13种肿瘤与肥胖相关
(
N Engl J Med 375, 794–798
)
。
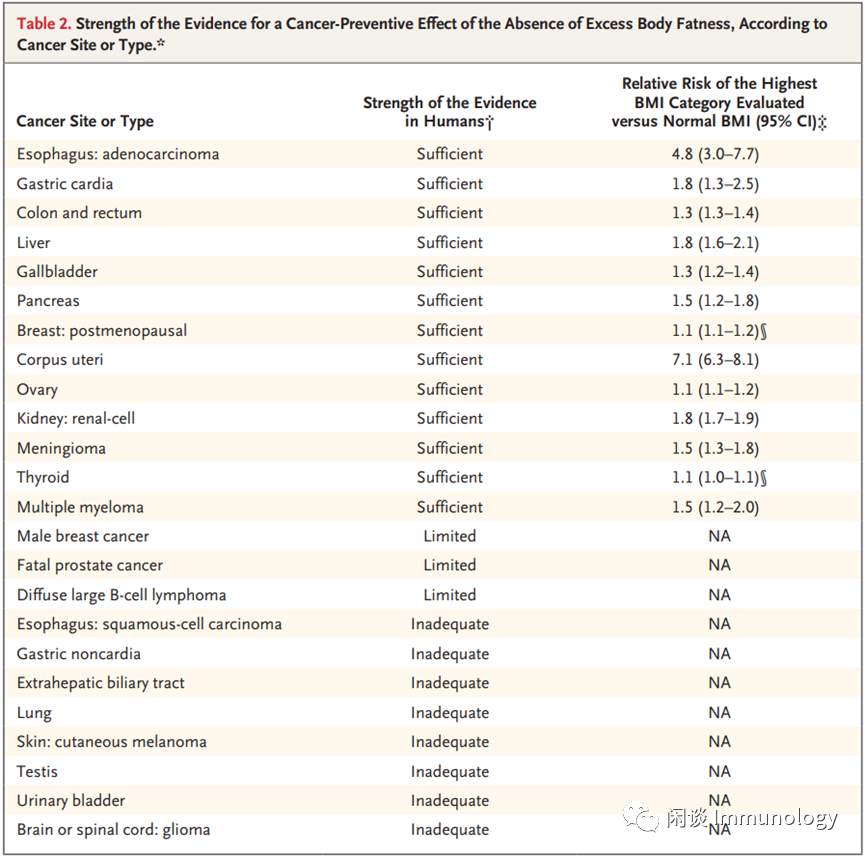
N Engl J Med 375, 794–798
第1乱:胰岛素和雌激素信号紊乱
胰岛素受体有两个亚型,IR-A和IR-B,以不同的比例存在于不同的组织中,执行不同的功能。
IR-A
在生命
早期
主要具有促进
有丝分裂
的作用,它在成年期的表达与胰岛素抵抗和不受调节的细胞增殖有关。
IR-B
在肝脏和其他成人组织中表达,并主要参与
葡萄糖代谢
。高水平的IR-A与肿瘤的发生有关,并在多种癌症中被发现,包括乳腺癌、子宫内膜癌、结肠癌和肝细胞癌。
与IR-B相比,IR-A对IGF表现出更高的亲和力。IGF-1和IGF-2是在肝脏中响应生长激素而合成的小肽。
虽然胰岛素主要以自由形式循环,但
IGFs
主要与IGF结合蛋白(IGFBPs)结合而循环,从而调节其水平和生物学功能。
IGF-1
和
IGF-2
通过与IGF-1受体(IGF-1R)结合,
促进细胞生长和增殖
,多项研究表明,IGF-1R在乳腺癌和子宫内膜癌中的表达增加。在肥胖的情况下,较高水平的IGF-2同时刺激IGF-1R和IR-A表达。
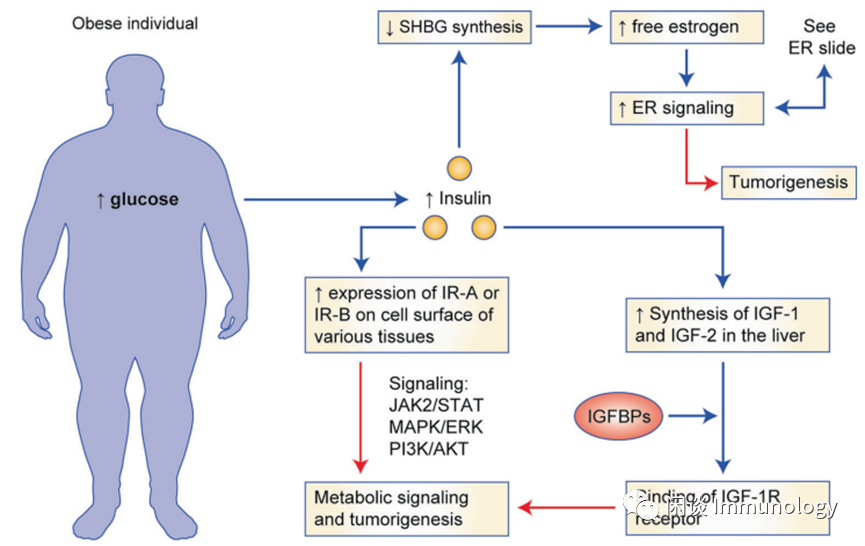
British Journal of Cancer (2021)125:495–509
肥胖患者
,胰岛素和IGFR长期被激活,导致细胞中葡萄糖摄取增加、细胞增殖、血管生成,并
最终产生恶性转化
和
恶性生长
的潜力。
内脏肥胖
(非皮下脂肪肥胖)是比BMI更好的肿瘤风险预测因子。因为内脏肥胖会增加循环的游离脂肪酸,进而增加高胰岛素血症和胰岛素抵抗的发生,增加促炎细胞因子分泌,引起胰岛素受体和IGFR的过度激活,
增加PI3K
活化,促进肿瘤增殖。
临床前模型中,PI3K抑制后,胰岛素的激增可以重新激活这一通路,并刺激进一步的肿瘤细胞增殖。
药物靶点:
IGF、IR-A、IGF1R、酪氨酸激酶。
存在的问题:鉴于IR和IGF1R在人体组织中的普遍存在性,靶向这些受体,会产生off-tumor的相关的毒性。
同时阻断IGF1R和IR可导致剂量限制性高血糖,仅抑制IGF1R可导致IR信号通路的代偿性激活。
Figitumumab是辉瑞研发的IGF1R单克隆抗体,与卡铂和紫杉醇联合治疗晚期非小细胞肺癌(NSCLC)。然而,由于严重不良事件的发生率增加,包括3/4级高血糖和与治疗相关的死亡,临床试验提前结束。
Astellas Pharma研发的小分子抑制剂,
靶向IGF1R and IR, 3期临床(
NCT00924989)
治疗
局部晚期或转移性肾上腺皮质癌,和对照组比较,无明显临床获益。没有新的临床研究开展。
Dusigitumab由
MedImmune LLC研发,IgG2λ抗体,靶向
IGF-2 和IGF-1,1期临床(NCT00816361,NCT01340040),最好的结果是疾病稳定(SD),未出现完全缓解(CR)或者部分缓解(PR)。没有新的临床研究开展。
由
Boehringer Ingelheim研发,IgG1抗体,结合
IGF-2 和IGF-1,首次人体临床试验(NCT01403974; NCT01317420),显示耐受性良好,125例病人出现2例PR。16例EGFR突变的NSCLC患者(NCT02191891),Afatinib 联合Xentuzumab (BI 836845) Phase1b,没有出现PR,10例SD。NCT02123823,将xentuzumab 加入 everolimus/exemestane,治疗HER2阴性,雌激素受体阳性患者,没有改善PFS,但在没有内脏转移的患者中,观察到了PFS改善,随后开展2期临床XENERA™-1 (NCT03659136)。
重新利用治疗糖尿病的药物在癌症研究领域取得一些进展。
在临床前模型中,二甲双胍可下调IGF信号通路,抑制子宫浆液性癌细胞的增殖。二甲双胍还能减弱乳腺癌、肺癌和胰腺癌细胞中IGF1的表达以及mTOR和Akt(胰岛素信号传导的下游效应因子)的激活。
在乳腺癌的新辅助治疗中,二甲双胍与其他细胞毒性药物联合使用,改善了病理完全缓解率,但没有改善转移性患者的PFS。用二甲双胍抑制IGF1和PI3K信号通路可以降低子宫内膜肿瘤中的细胞增殖。在small window-of-opportunity(术前)试验中,二甲双胍降低了患者的肿瘤增殖(标记Ki-67)11.75%(P=0.008),在另一项试验中降低了17.2%(P=0.002),但这些发现在验证性3期试验中没有得到重复。
第2乱:脂肪因子信号通路紊乱
脂肪组织分泌的
脂肪因子
(激素和细胞因子)
失调是过度肥胖的一个标志,可以促进肿瘤的生长。
瘦素(leptin)
,脂肪细胞分泌的激素和肥胖的生物标志物,主要功能是下丘脑介导的食欲调节,它调节进食行为和能量消耗。肥胖个体的循环瘦素水平升高,并与癌症发展和进展的风险增加有关,如子宫内膜癌、乳腺癌、结肠癌和肾癌等。
瘦素与瘦素受体结合,激活多个信号通路,包括JAK/STAT、MAPK和PI3K通路,最终促进细胞增殖。
通过瘦素受体传递的信号也能激活乳腺癌干细胞,是其存活和维持所必需的。胰岛素和IGF1也可以增加乳腺上皮组织中瘦素及其受体的表达,这种表达的增加与乳腺癌预后较差有关。瘦素可以刺激血管生成,增加血管通透性,使恶性细胞进一步生长。因此,
瘦素是肿瘤和肿瘤微环境(TME)之间相互作用的重要中介物
。
British Journal of Cancer (2021) 125:495–509
另一种由脂肪细胞分泌的激素是
脂联素(adiponectin)
,它具有抗糖尿病和抗炎的特性。肥胖和代谢综合征血浆脂联素水平降低,脂联素受体(AdipoR1和AdipoR2)的表达也降低,导致脂联素敏感性进一步降低。低脂联素水平与胰岛素抵抗和肥胖相关恶性肿瘤的风险增加有关,包括乳腺癌和子宫内膜癌。
脂联素激活AMPK通路,导致p53和p21的上调,从而调控细胞周期和凋亡。肥胖增加瘦素,降低脂联素水平,
瘦素/脂联素比值
被认为
是乳腺癌
生长的一个
预测因子
。其他脂肪因子的水平,如抵抗素(resistin)和内脂肪素(visfatin),在肥胖人体升高,是炎症的标志物,与各种癌症的发展和进展有关。抵抗素(resistin)被认为通过TLR4介导NF-κB和STAT3的激活来促进乳腺癌细胞的生长。
虽然瘦素和肿瘤发生发展的关系已经确定,但是目前尚无拮抗瘦素的药物进入临床。PEG-LPrA2是一种瘦素受体拮抗剂,已在三阴性乳腺癌的临床前模型中被研究,可以抑制瘦素信号通路并抑制乳腺癌的生长。
PPAR合成配体(罗格列酮和吡格列酮),是糖尿病治疗药物,通过调节葡萄糖代谢、减少高胰岛素血症和改变脂肪酸代谢。此外,PPARγ合成配体已被证明在临床前模型和人体研究,显示增加脂联素水平,可能有利于治疗肥胖驱动的癌症。
他汀类药物被广泛用于脂质水平管理,也可能具有抗癌特性。已经提出了几种抗癌机制的作用:通过抑制Ras和Rho激活,损害肿瘤细胞增殖;通过细胞周期阻滞抑制细胞增殖;诱导凋亡;剂量依赖性抑制血管生成;适当抗炎。但是临床结果并不一致。
第3乱:雌激素信号紊乱
British Journal of Cancer (2021)125:495–509
绝经后,雌激素主要来自于雄激素转化(通过雌激素生物合成酶,芳香化酶)。肥胖引起癌症发生的一个重要因素就是增加脂肪组织中芳香化酶活性。
二甲双胍
已被确定为一种潜在的乳腺特异性芳香化酶抑制剂。脂肪因子adiponectin和ghrelin也被证明以启动子特异性的方式抑制芳香化酶的表达,这可能有助于解释肥胖环境下低水平脂联素与乳腺癌生长之间的联系。
特异性甾体和非甾体芳香化酶抑制剂已证明对预防和治疗ER+乳腺癌有效,ER+乳腺癌发展或复发的风险降低约50%。芳香化酶抑制剂也可能在ER+子宫内膜癌中有临床应用,但目前临床疗效有限。
Anastrozole
是一种非甾体芳香化酶抑制剂,已被证明在新辅助治疗中可减少子宫内膜癌细胞的增殖,并对治疗复发性ER+子宫内膜癌具有一定的活性。
Trozole
(非甾体芳香化酶抑制剂)联合everolimus(mTOR抑制剂),未被选择的子宫内膜癌人群中,总有效率为32%。














