在
2017
年开年,将对在
2017
年中临床方面很有可能取得成功的药物或者是有极大可能上市批准的药物进行展望。
药物总览
|
Drug
|
Indication
|
Phase
|
Class
|
Company
|
|
Oliceridine
|
Acute Pain
|
III
|
NME
|
Trevena,Inc.
|
|
Dupixent
|
Atopic Dermatitis
|
BLA
|
Biologic
|
Regeneron Pharmaceuticals
|
|
AEVI-001
|
Attention Deficit Hyperactivity Disorder (ADHD)
|
II/III
|
NME
|
Aevi Genomic Medicine, Inc.
|
|
MPC-06-ID
|
Chronic Pain
|
III
|
Biologic
|
Mesoblast Limited
|
|
Resunab
|
Cystic Fibrosis
|
II
|
NME
|
Corbus Pharmaceuticals Holdings, Inc.
|
|
Translarna
|
Cystic Fibrosis (CF)
|
III
|
NME
|
PTC Therapeutics, Inc.
|
|
Nelotanserin
|
Dementia
|
II
|
NME
|
Axovant Sciences, Inc.
|
|
Inclisiran
|
Dyslipidemia /Hypercholesterolemia
|
II
|
NME
|
The Medicines Company
|
|
Tivantinib
|
Hepatocellular (Liver) Cancer (HCC) (Including Secondary Metastases)
|
III
|
NME
|
ArQule, Inc.
|
|
PRO 140
|
HIV/AIDS
|
III
|
Biologic
|
CytoDyn, Inc.
|
|
Austedo
|
Huntington’s Disease
|
NDA
|
NME
|
Teva Pharmaceutical Industries Ltd.
|
|
ZS-9
|
Hyperkalemia
|
NDA
|
NME
|
AstraZeneca PLC
|
|
Triheptanoin
|
Metabolic – General
|
II
|
NME
|
Ultragenyx Pharmaceutical Inc.
|
|
Telotristat Etiprate
|
Neuroendocrine Tumors (NET)
|
NDA
|
NME
|
Lexicon Pharmaceuticals, Inc.
|
|
Brineura
|
Neuronal Ceroid Lipofuscinosis (NCL)
|
BLA
|
Biologic
|
BioMarin Pharmaceutical Inc.
|
|
Brigatinib
|
Non-Small Cell Lung Cancer (NSCLC)
|
NDA
|
NME
|
ARIAD Pharmaceuticals, Inc.
|
|
Symproic
|
Opioid Induced Constipation (OIC)
|
NDA
|
NME
|
Shionogi & Co. Ltd.
|
|
Abaloparatide-SC
|
Osteoporosis/ Osteopenia
|
NDA
|
NME
|
Radius Health, Inc.
|
|
CVT-301
|
Parkinson’s Disease (PD)
|
III
|
Non-NME
|
Acorda Therapeutics
|
|
Xadago
|
Parkinson's Disease (PD)
|
NDA
|
NME
|
Newron Pharmaceuticals SpA
|
|
CR845
|
Pruritus
|
II/III
|
NME
|
Cara Therapeutics, Inc.
|
|
Siliq
|
Psoriasis
|
BLA
|
Biologic
|
Valeant Pharmaceuticals International, Inc.
|
|
Baricitinib
|
Rheumatoid Arthritis (RA)
|
NDA
|
NME
|
Eli Lilly & Company
|
|
Ingrezza
|
Tardive Dyskinesia
|
NDA
|
NME
|
Neurocrine Biosciences
|
|
Zoptrex
|
Uterine (Endometrial) Cance
|
III
|
NME
|
Aeterna Zentaris, Inc.
|
Oliceridine for Acute Pain
(
TRVN
)
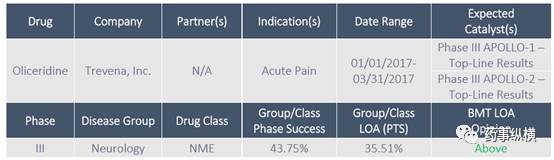
Oliceridine
是
mu-opioid
受体的非正型配体,在降低疼痛的同时可以将
mu-opioid
受体介导的副作用将至最小。
Oliceridine
通过作用于
mu-opioid
受体可以激活
G-
蛋白信号通路,从而抑制
β
-
抑制蛋白通路。
基于二期临床试验结果,
Oliceridine
分别在
2015
年
12
月和
2016
年
2
月获得
FDA
的快速通道及突破性疗法。
Oliceridine
对于治疗急性疼痛的三期临床研究包括两个实验:
APOLLO-1
和
APOLLO-2
。两项三期临床试验为多中心、随机、双盲安慰剂及活性对照组,目标在于
Oliceridine
对囊炎切除术及腹壁整形术后产生的中度至重度急性疼痛的治疗。
APOLLO-1
主要评估指标为囊炎切除术后
48
小时的疼痛缓解,
APOLLO-2
主要评估指标为腹壁整形术后
24
小时的疼痛缓解。主要终点是比较
Oliceridine
与安慰剂之间缓解疼痛的有效性,次要终点是比较
Oliceridine
与吗啡的临床安全性、有效性及耐受性。
Trevena
期望两项实验在
2017
年第一季度获得最优的结果,这个结果对于
Oliceridine
在
2017
年下半年的
NDA
计划是至关重要的。
Dupixent for Atopic Dermatitis
(
Eczema
)(
REGN
)

Dupixent
(
dupilumab
)由
Regeneron
进行开发,为
IL4-
受体抗体,可以抑制
2
型(包括
Th2
)免疫应答中两个关键的细胞因子
IL-4
和
IL-13
的信号。
Dupixent
目前在开发与过敏相关的
5
个适应症,针对于过敏性皮炎(湿疹)
BLA
已提交至
FDA
,针对于哮喘关键的三期临床正在进行。
Regeneron
认为已经找到多种过敏性疾病的“控制点”,并且认为这个药物的适应症可以拓展至食物过敏。
2014
年
FDA
批准了
Dupixent
治疗成年人中度至重度过敏性皮炎(对于其他治疗无效或者不适用)的突破性疗法。目前,在关键的三期临床阶段,针对成年人过敏性皮炎适应症已获得了重要的有效性数据。临床研究的目标在于,
Dupixent
对过敏性皮炎的单独治疗(
SOLO1
和
SOLO2
)和联合外用糖皮质激素治疗(
CHRONOS
)。
FDA
针对过敏性皮炎的
BLA
在
2017
年
3
月
29
日会有初步结果,
Regeneron
期望能在
2017
年底提交关于哮喘的备案文件。一旦
Dupixent
被批准,将作为最先进的药物弥补上述领域治疗药物的不足。
AEVI-01 for Attention DeficitHyperactivity Disorder
(
ADHD
)(
GNMX
)

AEVI-001
为非兴奋剂类亲代谢性谷氨酸受体神经调节物质,
Aevi Genomic Medicine
(原
Medgenics
)这个季度将会获得
AEVI-001
的最新数据,以支持接下来的注意缺陷多动障碍(
ADHD
)项目进入三期临床阶段。
AEVI-001
正在进行
SAGA
(
Study of Adolescent Glutamate Receptor Network Copy Number VariantADHD
)二期
/
三期临床研究,主要针对人群为具有
mGluR
阳性突变的
ADHD
在
12-17
岁的青年患者。
SAGA
试验的目的在于确认
1b
的结果,同时寻求在青少年中的最佳剂量。主要和次要终点分别为,
ADHD-RS-5
(
ADHD-rating scale Version 5
)总分数基线的改变以及由
CGI-I
决定的应答百分数。如果有积极的结果,三期临床将被允许在小儿及青少年病人中开展。将使得
Aevi
拥有的
AEVI-001
在治疗
mGluR
阳性突变的
ADHD
方面,目前将取得独一无二的地位。
Aevi
预估在美国患有此种疾病的儿童大约有
120-150
万,这将是
20-30
亿美元的一个大蛋糕。
MPC-06-ID for Chronic Pain
(
MESO
)
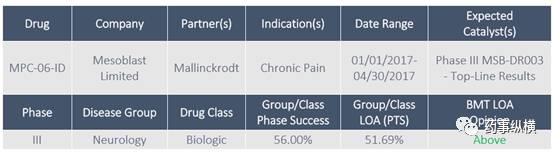
MPC-06-ID (rexlemestrocel-L)
是一个基于
adult-derived
间叶细胞前体细胞(
MPCs
)同种异体干细胞产品,由
Mesoblast
进行开发,注射入损坏的腰间盘从而治疗背部疼痛。
Rexlemestrocel
的多个处方正在研究用于治疗充血性心力衰竭(
CHF
;
Phase
Ⅲ
),骨髓移植(
Phase
Ⅲ
),以及其他处于早起临床阶段的适应症。
Mesoblast
期待
2017
年初
MPC-06-ID
用于治疗下腰疼痛三期临床的中期数据,以便于和
FDA
的进一步探讨。
Mesoblast
目前对于
MPC-06-ID
治疗此适应症,已不再公开宣布所预计的受理和商业化的时间表,之后的申请及批准很大程度上将取决于收个三期临床试验的结果。
Resunab for Cystic Fibrosis
(
CRBP
)
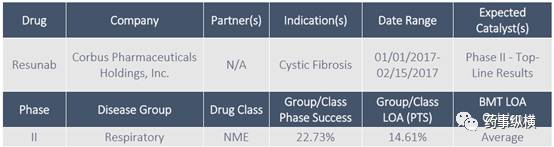
Resunab
是一个人工合成的内源性大麻素类似药物,意在与治疗慢性炎症及组织纤维化。
Corbus
开发的此药物,为包括囊胞性纤维症(
CF
)在内的多个适应症的首选候选药物。在治疗
CF
方面,
Resunab
在
2015
年获得了
FDA
的孤儿药地位及快速通道,
2016
年
10
月获得了欧盟的孤儿药地位。
二期临床
CF-001
主要目的在于评估安全性及耐受性,同时也能提供
Resunab
在治疗
CF
方面的临床有效性,以及肺功能和症状。根据目前完成的研究,预计在
2017
年一季度末能获得最新的有效的临床数据。如果临床有效性的结果是消极的,
Corbus
将会由
CF
转向二期临床结果更加积极的系统性硬化症方向。在
CF
治疗上如果由积极的结果,通过以上适应症的研究将更加坚定的支持
Resunab
的作用机制。
Translara for Cystic Fibrosis
(
CF
)(
PTCT
)
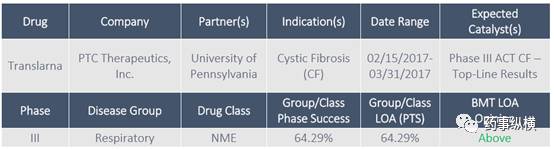
Translarna (ataluren, PTC124)
是口服治疗无意义突变导致的家族遗传疾病,
PTC
治疗的三期临床试验主要是对
Cystic Fibrosis
(
CF
)的治疗。
Translarna
对肌肉萎缩的治疗在
2014
年
7
月已获得欧盟的批准,
2017
年一季度有望在
FDA
提交注册申请。针对于
CF
适应症的三期临床
ACT CF
研究,在
2017
年一季度也将获得最新的数据。
Nelotanserin for Dementia
(
AXON
)
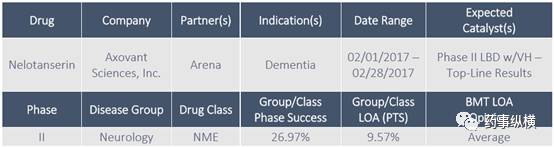
Axovant
预计在
2017
年
2
月份,对于
nelotanserin
治疗路易体痴呆(
LBD
)病人的视觉幻觉最初的
10
例患者的二期临床研究初步数据将被获得。
Nelotanserin
为高选择性的血清素
5HT2A
受体的反向激动剂。在
AAIC
(
Alzheimer’sAssociation International Conference
)上展现的数据显示,已完成的
7
项研究,
nelotanserin
是基本安全且有较好的耐受,一般会诱发头痛、嗜睡及头晕。
Repatha forDyslipidemia/Hypercholesterolemia
(
AMGN
)
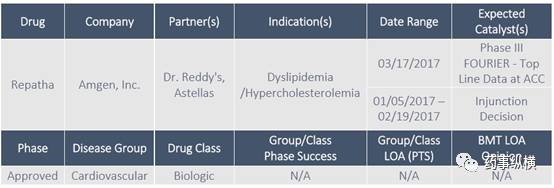
Inclisiran for Dyslipidemia/ Hypercholesterolemia
(
MDCO
)

在
2015
年
PCSK9
抑制剂
Repatha
批准上市,但销售额确非常暗淡,主要是因为患者无力承担高昂的费用。自从
PCSK9
抑制剂仅批准用在降
LDL-C
方面,
Repatha
的
CV
数据结果在
ACC
的年度科学会议上,又让大家充满了期待。积极的结果鼓励医生使用此类药物,但是高昂的药价仍然不可忽略。
同时在
ACC
会议上,
RNAi
治疗药物
inclisiran
也展现了完整的二期临床
ORION 1
的研究数据。初步的数据显示
inclisiran
只需要
2-3
次
/
年,对于
Repatha
一周或者一月一次的服用周期来说有较大的临床优势,并且所有的数据均支持目前的结论、对药物的期待以及对安全性的确认。企业对最终剂量的确定有更加详尽的信息,以及是否需要增加数据来支持最终剂量的确定。
Tivantinib for Hepatocellular
(
Liver
)
Cancer
(
HCC
)(
IncludingSecondary Metastases
)(
ARQL
)
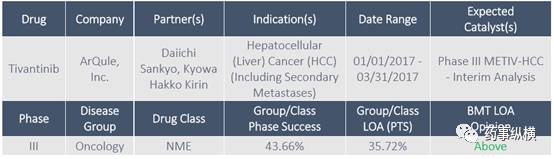
Tivantinib
为口服
MET
受体络氨酸激酶抑制剂,作为二线治疗
HCC
目前在三期临床阶段,对于
ArQule
是优选管线的候选药物。
ArQule
在
SPA
及
FDA
的指导下进行三期临床
METIV-HCC
的研究。招募已经完成,共有
368
位患者参加到双盲、安慰剂对照组的试验中,关键的与
tivantinib
的头对头临床研究,患者随机比例为
2:1
,从而期望能获得更多的支持。
ArQule
预计在
2017
年一季度能获得关键三期临床
METIV-HCC
的研究结果。
PRO 140 for HIV/AIDS
(
CYDY
)
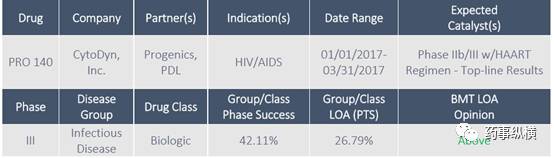
CytoDyn
预计
2017
年一季度将获得来自于
PRO140
的
Ⅱ
b
及
Ⅲ
期临床关键终点结果,
PRO140
为针对于
CCR5
拟人
IgG4
的单克隆抗体,联合标准治疗方案针对经过治疗的
HIV
患者。
PRO140
是
CytoDyn
在
2012
年
7
月从
Progenics
获得。
PRO140
通过结合关键共受体
CCR5
,抑制主要的
HIV
(
R5
)亚型进入
T
细胞。
根据目前积极的临床数据结果,
CytoDyn
计划针对于经治疗重度
HIV
患者向
FDA
申请突破性疗法,如果
FDA
批准,
PRO140
将会是收个用于治疗
HIV
的单克隆抗体。
Austedo for
Huntington’s Disease
(
TEVA
)
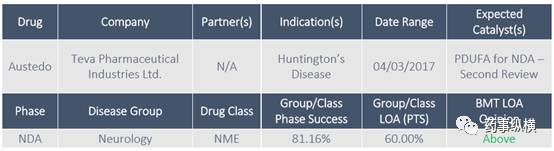
FDA
已经接受了
Austedo(deutetrabenazine)
用于治疗亨廷顿氏舞蹈症重新提交的
NDA
申请。
Austedo
为氘带四苯喹嗪(丁苯那嗪)类似物,特异性靶点是囊泡单胺转运蛋白
2
(
VMAT2
)。
2014
年
11
月在治疗亨廷顿氏舞蹈症方面
Austedo
获得了孤儿药地位,基于两项三期临床试验(
First-HD
和
ARC-HD
)的积极结果,
FDA
在
2015
年
8
月接受了
NDA
申请。
2016
年
5
月,
Teva
宣布收到了来自
FDA
的
CRL
。
FDA
对于批准首个氘带药物还是非常谨慎,要求
Teva
检测血液水平确定的代谢产物。如果重新提交获得成功,
Austedo
将是首个
FDA
批准的氘带药物,并且仅仅是第二个
FDA
批准用在亨廷顿氏舞蹈症的药物。
ZS-9 for Hyperkalemia
(
AZN
)
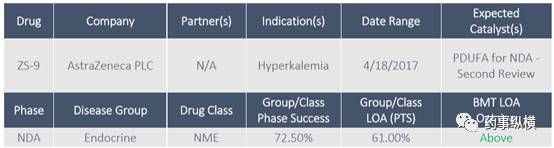
ZS-9
为硅酸锆结晶,用作吸附剂,主要作为是在胃肠道捕获过剩的钾离子。
ZS-9
在治疗高血钾症方面已经得到
FDA
的批准,预计在
2017
年
4
月
18
日可获得
PDUFA
的数据,同时也在等待
EMA
在欧洲市场的批准。
在
ZS-9
的两项三期临床试验,入组大约一千位患者,一项目的是安全性和有效性,另一项为持续性治疗。基于积极的三期临床结果,
ZS Pharma
(
2015
年
12
月被
AstraZeneca
收购)在
2015
年
5
月
26
日向
FDA
提交了
NDA
并且在
2015
年
7
月
29
日被
FDA
接收,
2016
年
5
月
26
日公布了初步的
PDUFA
数据。
Triheptanoin for Metabolic-General
(
RARE
)
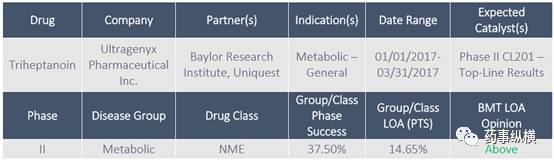
Ultragenyx
预计
2017
年一季度公布
triheptanoin
在
Glut1
缺乏症(
Glut1
DS
)
患者的二期临床数据。在
Glut1DS
中,蛋白转运葡萄糖至大脑的缺陷,导致大脑供能不足,将会引起痉挛、发育迟缓及行动障碍。
Triheptanoin
为合成的甘油酸三酯,其代谢产物可以进入大脑提供能量。
分别在
2014
年和
2015
年
FDA
和欧洲委员会双双通过了
triheptanoin
在治疗
Glut1 DS
方面的孤儿药地位。今年,
Ultragenyx
希望基于
triheptanoin
治疗
FAOD
(脂肪酸氧化代谢障碍)的三期临床初步结果,同样获得美国和欧盟的孤儿药地位。
Telotristat Etiprate forNeuroendocrine Tumors
(
NET
)(
LXRX
)

Telotristat etiprate
治疗类癌瘤综合症的
NDA
正在被
FDA
审核,
PDUFA
的时限在
2017
年
2
月
28
日。
Telotristatetiprate
是口服小分子靶向作用于色氨酸羟化酶,此酶可以在转移性神经内分泌肿瘤细胞中刺激产生过剩的
5-
羟色胺,从而导致类癌瘤综合症。
5-
羟色胺在胃肠(
GI
)道的多个生理过程起到重要的作用,包括分泌、感觉和能动性。
基于三期临床的积极结果,
Lexico
在
2016
年
3
月向
FDA
提交了
NDA
,并且同时申请快速通道及孤儿药地位。
2016
年
5
月
FDA
批准了
NDA
的优先审评,
PDUFA
的目标日期为
2016
年
11
月
30
日。根据
FDA
的审核要求,需要
Lexico
补充提交临床数据分析,因此
PDUFA
的时间延迟三个月,至
2017
年
2
月
28
日。
Brineura for Neuronal CeroidLipofuscinosis
(
NCL
)(
BMRN
)
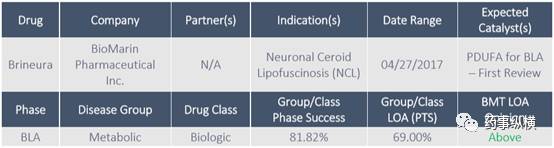
FDA
目前在对
Brineura(cerliponase alfa)
进行初步审核,是一种通过注射入脑室的酶补偿疗法,用于治疗儿童到的
CLN2
疾病,贝敦氏症的一种,
FDA
设定的
PDUFA
时限在
2017
年
4
月
27
日。
FDA
及
EMA
均批准了
cerliponasealfa
的孤儿药地位,并且
FDA
还批准其优先审评和突破性疗法。
BioMarin
已经向
EMA
提交了此品种的
MAA
(市场营销授权申请)。
EMA
也同意了
BioMarin
要求的加速审评,并且申请正在校验中。
Brigatinib for Non-Small CellLung Cancer
(
NSCLC
)(
ARIA
)
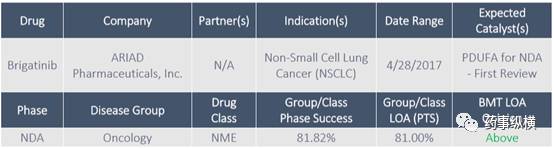
Brigatini
是一种间变性淋巴瘤激酶抑制剂,用来治疗
ALK
突变的
NSCLC
患者。
Brigatini
由
ARIADPharmaceuticals
开发,希望
FDA
能批准用于治疗
ALK+NSCLC
对
crizotinib
耐受的患者,并且希望能成为主要的
ALK
抑制剂一线治疗药物。
基于临床
ALTA
研究的积极结果,在开发期间就接到了
FDA
批准的孤儿药地位和突破性疗法,并且
FDA
也接受了
ARIAD
提交的优先审评。
FDA
设定的
PDUFA
时限为
2017
年
4
月
29
日,由于恰逢周末,我们可以期待在那周周五之前就可以有
PDUFA
的决定。














