►脑卒中的治疗是一场和时间的赛跑,图片来自medscape.com
撰文 | 丁旭隆(四川大学生物治疗国家重点实验室)
责编 | 徐 可
● ● ●
俗话说:“少怕歪,老怕摔。”我们除了要知道在老人摔倒后及时采取相应的治疗措施,同时也要了解老人为什么会摔倒。很多人会说中风或者脑溢血。的确,打开百度,将“老人晕倒”和“中风”同时搜索,立马会弹出许多相关的新闻。那么,中风到底是个什么样的疾病呢?
中风,学名脑卒中(stroke)。我们常说的脑溢血是脑卒中的一类,学名出血性脑卒中(hemorrhagic stroke,HS),它是由于脑部血管突然破裂导致脑组织损伤,只占脑卒中发病的20%-30%。而脑卒中中最常见的一类是缺血性脑卒中(ischemic stroke,IS),下图显示了其发病原因:脑部供血血管内壁产生血栓,脱落后堵塞动脉血管,导致大脑供血不足而坏死。
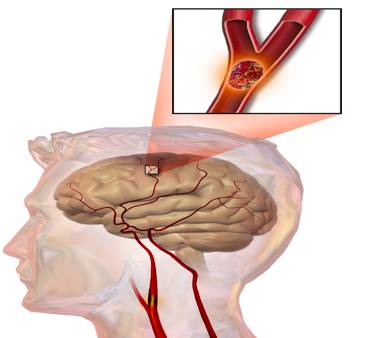
►图1 大脑某处血管发生堵塞诱发缺血性脑卒中,图片来自wikipedia
目前,脑卒中已经成为威胁人类生命的第二大杀手,根据美国心脏协会(AHA)2017年对心脏病和卒中流行病学统计数据,在美国,20%的死亡是由于脑卒中。大约每40秒就有一人发生脑卒中。下图是1990和2013年年龄标准化的缺血性脑卒中患者死亡率变化情况和2013年缺血性脑卒中年均伤残调整寿命年比率。从图中可以看出,虽然大多数地区的死亡率相比之前有所下降,但是由于现有的治疗措施只是通过手术或者药物治疗清除堵塞血管的血栓,并不能挽救血管周围受损的神经,所以其致残率逐年攀升。因此,迫切需要有一种更加有效的治疗方法。
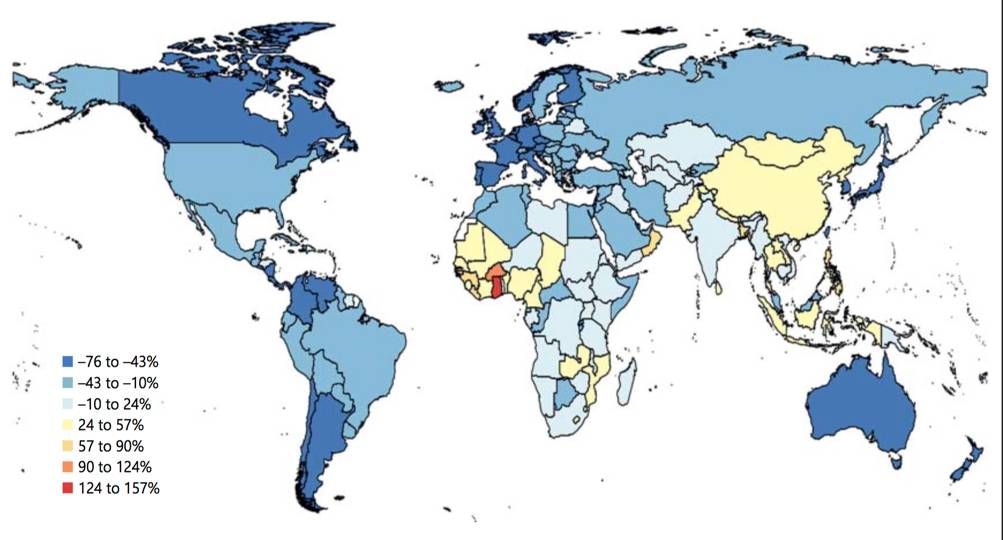
►图2 1990和2013年缺血性脑卒中患者年龄标准化死亡率变化百分比,图片来自karger.com
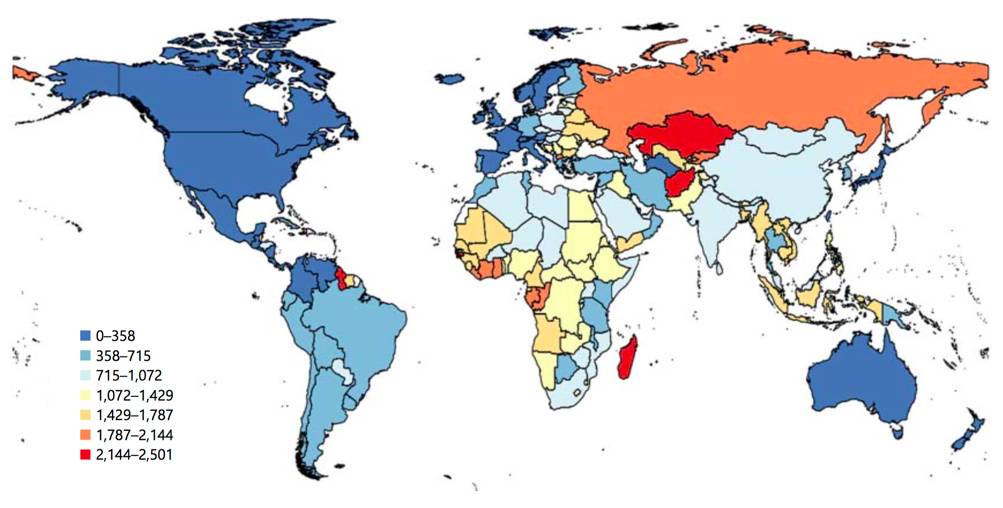
►图3 2013年缺血性脑卒中年龄标准化年均伤残调整寿命年比率(每十万人),图片来自karger.com
就像房子需要一定的钢筋来支撑房子的结构,在细胞中有着微管(microtubule, MT)、微丝(microfilament, MF )及中间纤维(intermediate filament, IF )组成的细胞骨架体系(cytoskeleton)来维持细胞的形态。在这其中,tau蛋白(microtubule-associated protein tau)发挥了重要的作用。它与微管蛋白结合促进其聚合形成微管,并且与形成的微管结合,维持微管稳定性,降低微管蛋白分子的解离,并诱导微管成束。
这样一个重要的蛋白质,一旦发生病理性变化,后果不堪设想。下图是病理性的tau蛋白在阿尔茨海默症(alzheimer’s disease, AD)中的作用过程。红色的条状物代表生理状态下的tau蛋白,此时它们正结合在微管上稳定微管的结构。一旦tau蛋白被一些磷酸激酶作用变成了磷酸化的tau蛋白,它们就会从微管上脱落,然后逐渐聚集,形成神经纤维缠结(neurofibrillary tangles, NTFs)。神经元微管结构被广泛破坏,正常轴突转运受损,引发突触功能损伤,脑神经发生退行性病变。
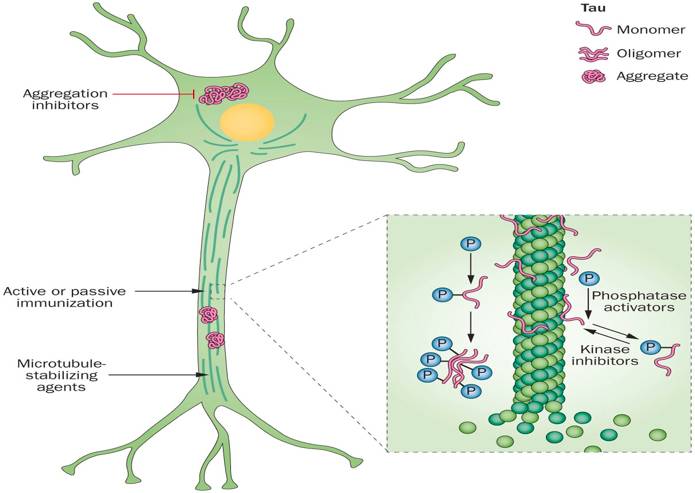
►图4 Tau蛋白在阿尔茨海默症中相关病变示意图,图片来自nature.com/nature-reviews-neurology
那么看似毫不相关的脑卒中和tau蛋白之间存在什么联系呢?近日,来自四川大学和新南威尔士大学的科学家分别从离子和蛋白的角度揭示了tau蛋白在脑卒中引起的神经细胞损伤中起到的作用。
四川大学雷鹏课题组与华中科技大学刘蓉课题组合作,9月8日在Nature 子刊Molecular Psychiatry在线发表论文,该文章将tau蛋白,缺血性脑卒中和铁离子三者联系起来。铁是人体内含量最高的微量元素,广泛存在于各个组织和器官中,它是构成血红蛋白、肌红蛋白及多种酶的重要成分。同时铁离子还能介导细胞死亡——铁死亡(ferroptosis),这与本研究关系密切。雷鹏团队发现, tau蛋白的主要功能之一是将多余的铁离子从大脑中运出,避免铁离子的积累。而在脑卒中发生后大脑中的tau蛋白发生病理性变化,造成铁离子转运障碍,导致铁离子沉积,从而引起细胞发生铁死亡,这样进一步加剧了卒中病人的脑损伤。
那么,我们可以这样思考:既然病理性的tau蛋白介导了铁死亡过程,那如果我们从一开始就将tau基因敲除是不是能阻止这个通路呢?研究人员依据这个思路选用tau基因敲除小鼠进行实验。首先是对比三个月大(相当于人15岁的年纪)的正常鼠和tau基因敲除鼠,构建缺血性脑卒中模型,然后进行相应的指标检测(神经功能评分,脑缺血面积,铁离子水平等)后,发现脑卒中关键指标都有了显著的改善,这说明对于3月龄tau基因敲除小鼠来说,tau蛋白的缺失的确能够缓解脑卒中发生后的损伤。随后研究人员又对比了12个月大的(相当于人50岁的年纪)正常鼠和tau基因敲除鼠,结果却发现12个月大的tau基因敲除鼠的脑卒中症状并未有所缓解。那么问题出在哪里?对比这两个实验,我们可以发现唯一的变量就是年龄。12个月大小鼠相当于中老年人,而年龄对于脑卒中来说是一个非常重要的危险因素,也很有可能影响脑卒中的治疗。
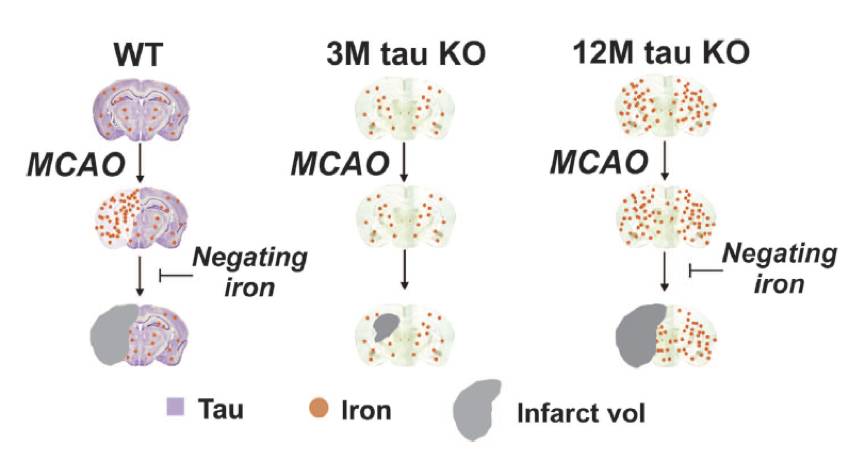
►图5 tau蛋白影响脑卒中发生后铁死亡通路的原理
那么,对于老年的脑卒中患者,我们能提出怎样的治疗思路呢?除了病理性tau蛋白,更重要的是造成铁死亡的铁离子。如果我们能够抑制铁死亡这个过程,那么应该也能缓解脑卒中的损失,特别是对于老年患者。研究人员据此对12个月大的tau基因敲除小鼠和正常小鼠进行了实验。在对小鼠分别注射铁死亡抑制剂Liproxstatin-1和Ferrostatin-1后,研究人员惊喜地发现,12个月大的tau基因敲除小鼠的脑卒中损伤又有了明显的改善。这说明在脑卒中发生后使用铁死亡抑制剂的确能够缓解脑卒中的损伤。这个研究解释了tau蛋白,缺血性脑卒中和铁离子三者之间的联系,揭示了tau蛋白通过调节铁离子转运而在缺血性脑卒中中发挥作用。
几乎是同一时间,来自新南威尔士大学的Ittner教授在Nature Communications在线发表论文,这篇文章从蛋白质的角度解释了tau蛋白和缺血性脑卒中之间的关系。在上篇文章中我们知道3月龄的tau敲除小鼠的脑卒中症状有明显缓解,但是我们并不知道敲除tau蛋白为什么会起到这样的功效。
那么,该如何进行研究呢?首先我们知道敲除tau蛋白后有着治疗作用,那么可能是tau蛋白在脑卒中发生后起着直接的毒性作用,也有可能是间接的毒性作用;然后根据之前的研究,可以基本排除tau蛋白具有直接的毒性作用,联系体内蛋白具有的相互作用关系,也许可以假设tau蛋白通过抑制某一个蛋白的作用来加重脑卒中的损伤。基于这个设想,研究人员同样利用tau基因敲除小鼠和正常小鼠的脑卒中模型进行实验,令人兴奋的是,他们发现了一个名为SynGAP1的蛋白起着重要的作用。
下图显示了脑卒中发生后的病理过程。我们知道神经元和神经元之间通过突触(Synapse)来传递信息,而神经递质(neurotransmitter)在突触传递中是担当“信使”的特定化学物质,下图的Glut即谷氨酸就是神经递质的一种。在发生脑卒中后,Glut由于细胞内电位的变化而向细胞外扩散。神经递质的扩散需要细胞膜上受体的协助,即下图NMDAR(N-甲基-D-天门冬氨酸受体),在扩散到细胞外后,聚集的Glut会引起钙离子的增加。那么钙离子起着什么作用呢?钙离子能够帮助GTP激活Ras蛋白而引发一系列的下游反应而造成大脑损伤。我们可以看到tau蛋白在这其中并未起着毒性作用。再看右图,在tau基因敲除后,前面的过程是一样的,但是当钙离子和GTP将要发生作用时,之间与tau蛋白相连的SynGAP1通过水解GTP从而阻止Ras激活,这样,下游的一系列毒性反应也不会发生了。这说明了SynGAP1在脑卒中发生后是有着保护作用的,但是tau蛋白抑制了这种保护作用。
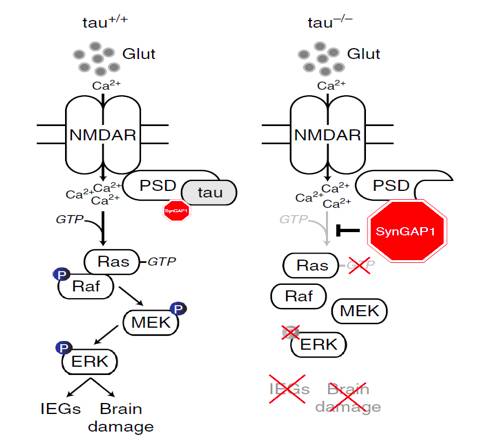
►图6 tau蛋白影响脑卒中发生后SynGAP1蛋白保护作用的原理
上面的两个研究是分别从离子和蛋白的角度揭示了tau蛋白在脑卒中引起的神经细胞损伤中起到的作用。看似关系不大,但其实两篇文章的结果是相互补充的。首先两篇文章选用的是不同品系的tau基因敲除小鼠,而且都证明了tau基因敲除后能够缓解脑卒中损伤;其次,两篇文章对小鼠模型的脑缺血时间不同,这可以模拟病人在发病到送到医院所经历的时间;最后,目前已经有学者证明第一篇中的铁死亡通路和第二篇中的谷氨酸毒性通路有着类似的机制,它们的发生都是依赖铁离子和Ras蛋白。谷氨酸的氧化毒性可能与未知的某些死亡类型部分同时发生,这种死亡类型可能就是铁死亡,并且铁死亡是细胞发生谷氨酸氧化毒性的结果。
大约10年前,脑卒中的药物开发是一个非常热门的领域,但由于大多数治疗性卒中试验失败导致研究陷入低谷。以上两个研究是对脑卒中这种分子水平上尚不甚了解的疾病的新见解,我们需要这些新的见解来向彻底治愈脑卒中的道路上迈进。
参考文献
1.Benjamin EJ, et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 2017 Mar7;135(10):e146-e603.
2.Feigin VL, et al.Atlas of the Global Burden of Stroke (1990-2013): The GBD 2013 Study. Neuroepidemiology. 2015; 45(3):230-6.
3.Giacobini E, Gold G. Alzheimer disease therapy--moving from amyloid-β to tau. Nat Rev Neurol. 2013 Dec;9(12):677-86.
4. Tuo QZ, et al. Tau-mediated iron export prevents ferroptotic damage after ischemic stroke. Mol Psychiatry. 2017 Sep 8. doi: 10.1038/mp.2017.171.
5.Bi M, et al. Tau exacerbates excitotoxic brain damage in an animal model of stroke. Nat Commun. 2017 Sep 7;8(1):473.
制版编辑: 艾略特|

购买课程
请点击下方“阅读原文”
▼▼▼点击“阅读原文”,了解课程详情,立享限时特惠














