将各稀释度的病毒液接种到单层细胞培养环境中,吸附2小时后,在单层细胞上覆以琼脂糖,病毒感染细胞并在细胞中增殖,使细胞破裂死亡。由于固体介质的限制,释放的病毒只能由最初感染的细胞向四周扩展。经过几个增殖周期,便形成一个局限性病变细胞区,即病毒蚀斑。经中性红活细胞染料着色后,活细胞显红色,而蚀斑区细胞而不着色,形成不染色区域。
病毒蚀斑如噬菌体感染细菌形成的噬菌斑。理论上,当病毒液充分稀释后,获得的每个蚀斑均源于最初感染细胞的一个病毒颗粒,即蚀斑中的病毒为一个病毒体的繁殖后代品系,由此达到纯化病毒的目的。除了可用于纯化病毒以外,空斑实验还可用于干扰素、抗体中和病毒繁殖能力的实验。凡是能使宿主细胞产生细胞病变效应(cytopathic effect,CPE)的病毒都可以采用蚀斑技术来分离和测定。
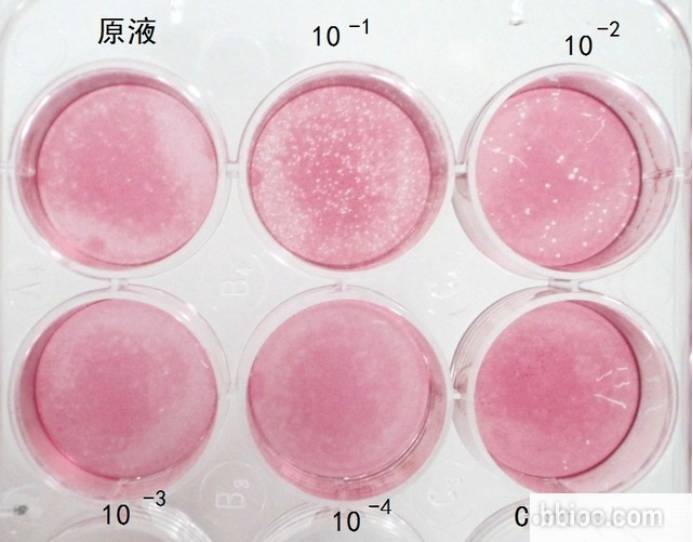
蚀斑技术除了可用于病毒纯化以外,还可用于测病毒滴度,其中所涉及的实验操作相似。此处献上2014年发布与JoVE上,通过空斑技术测病毒滴度的实验操作视频,为大家提供最直观的介绍。
来源:qq视频
1. 准备相应的病毒宿主细胞,消化均匀后调节细胞浓度,以适宜的浓度接种于六孔板中;
2. 待细胞长成单层后吸弃培养液;
3. 准备病毒液,进行十倍梯度稀释,获得五个浓度的病毒液。分别向每孔滴加适量病毒液,37°C下吸附2小时吸弃病毒液;
4. 制备2% 的低熔点琼脂糖溶液,置40~50°C水浴中待用;
5. 将上述琼脂糖与2×细胞维持液按1:1的比例混匀后,加入各培养孔中,2 mL/孔,冷却后凝固成覆盖层;
6. 倒置培养板,置于37°C二氧化碳培养箱中培养;
7. 每天观察细胞病变情况,出现明显病变时进行二次覆盖。取上述方法混合的混合液,加入中性红使其浓度为0.002%,向各培养孔中加入2 mL混合液,使其冷却凝固形成第二覆盖层;
8. 倒置培养板,置于37°C二氧化碳培养箱中继续培养,48小时内观察结果;
9. 选取合适大小的蚀斑下作病毒的下一步增殖和鉴定。使用1 mL的蓝色枪头,提前剪掉尖端部位,使枪头口径与蚀斑大小相仿,然后用移液器直吸取蚀斑,覆盖物也一起被吸入枪头。
(1) Q: 接毒细胞孔中细胞大量死亡,基本无病毒稀释度的差异?
A: 可能的原因如下:① 病毒稀释度不够。可先确定病毒滴度,再根据滴度选择稀释度;② 琼脂糖覆盖时温度太高;③ 实验所用细胞系不适合做蚀斑实验,可更换细胞系再尝试; ④ 观察时间比较晚。建议第一次做时,每隔12 h观察一次,大致了解细胞病变所需时间)。
(2) Q:做覆盖时琼脂糖和培养基混合液凝固得太快,还没加进去细胞培养孔里便凝固了,怎么办?
A:做蚀斑实验最关键的一点在于覆盖时动作既要缓慢以防止气泡产生,又要动作快,防止混合液凝固。一般六孔板的孔加2~3 mL就够了,可以用10 mL的吸管吸够10 mL可以加四个孔。还有就是,假如需要用30 mL的混合液铺板,那就需要多配至少20 mL,这样也可以防止因混合液太少,温度下降得快而较快凝固。
(3) Q:琼脂糖和培养液如何配制?
A:琼脂糖用三蒸水配成两倍浓度,培养液也配为两倍浓度。使用时,琼脂糖高温融化,在42°C保温,两倍浓度培养液在42°C水浴中恒温后,二者一比一混合保温于42度,尽快铺板。另外,中性红染液可以选择过滤除菌。
识别微信二维码,添加生物制品圈小编,符合要求即可有机会进入生物制品圈微信交流群!
注明:姓名+研究方向!


版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制品圈”。












