对于当前的制药行业,最令人关注且开展的如火如荼的工作,非仿制药的一致性评价莫属。一方面是为了保证并延续已有的产品管线,另一方面是为了在新仿制药品种的竞争中捷足先登、占领市场。而我们的CFDA、CDE及中检院在此过程中也是煞费苦心,频频出招以破解各位的心中疑惑。
一致性评价发展历程
有关我们国家开始决定进行仿制药一致性评价的工作,最早可以追溯至2012年的元月份。2012年1月20日国务院颁发的第5号文《国家药品安全“十二五”规划》中,就已将药品安全问题提高到了一定高度,并透漏出“部分仿制药质量与国际先进水平存在较大差距”的信息,同时制定了“全部化学药品、生物制品标准达到或接近国际标准,中药标准主导国际标准制定”的目标。2012年底至2013年,CFDA明确通知大家:仿制药一致性评价工作真的是要开始了。虽然在之后的2014年中CFDA没有时刻警醒大家一致性评价的重要性,但是从2015年开年各种关于仿制药一致性评价的通知、通告、征求意见稿及意见就如同雨后春笋般开遍CFDA及CDE的门户网站。从那时起,每一个制药人也习惯了等待总局在每个周末或者假日前夕给大家布置“作业”。时至今日,仿制药的一致性评价工作已渗透到了工作的每一个角落。
一致性评价的工作任务
在仿制药一致性评价工作准备期,CFDA就给自己制定了比较严苛的工作任务:
2012年:开展工作调研,完成前期准备工作,启动15个基本药物品种质量一致性评价的试点;
2013年:全面启动仿制药质量一致性评价,发布相关技术指导原则、工作程序,完善工作制度,开展50个基本药物品种质量一致性评价方法和标准的制定;
2014年:全面开展其他基本药物品种质量一致性评价方法和标准的制定;
2015年:全面完成基本药物目录品种质量一致性评价方法和标准的制定;基本完成2012年~2014年部署的质量一致性评价品种的质量一致性审查工作;
2015年-2020年:全面完成基本药物质量一致性审查,开展并完成其他临床常用品种质量一致性评价工作。
目前对任务的完成情况进行总结,CFDA是否会感到当初对自己下手有点狠。而对于制药行业来说也是时间紧、任务重,结合企业自身及资源情况,还是应当有取舍的进行工作开展。虽然此次一致性评价针对的是固体口服制剂,但在CFDA最初制定的任务中提到:2015年至2020年开展注射剂及其他剂型的质量一致性评价工作。因此,对于生产、在研及准备开发的非固体口服制剂的仿制药,我们是否也考虑该提前做些什么。
CFDA一致性评价发文情况

征求意见稿及定稿汇总

其他汇总

从不同阶段针对不同工作内容征求意见稿的发出,以及对比征求意见稿及最终稿的内容,还是可以发现,总局的各位领导、老师也是用心良苦。不仅要保证药品质量,也要保证工作的开展有可操作性,还要考虑到企业遇到的实际问题的解决方式;不仅要淘汰产能过剩、质量低劣的药品,也要保证特殊时期产出的特殊品种暂时有可生存的空间,给一些制药企业一定的喘息空间。细想来,此次的一致性评价“运动”还是结合我国国情,有人情味的。
临床方面
关于临床,对于制药行业来说,首先映入脑海的就是“722惨案”,现在想起也是隐隐作痛。从总局方面来讲到是一举多得:首先、通过临床核查,打消了人们在临床数据上做手脚的念头;其次、消灭了大量积压的待审品种,从而解放了手脚;再次、规范了临床市场;最终、从终端保证了一致性评价的真实可靠。但是,目前医院资源的紧缺、临床费用的飞涨,也给企业带来了相当大的困扰及压力。
药学方面
对于药学来说,总局把好临床这一关,药学方面的改进就是水到渠成的事情了。想要把药学和原研搞到一致,就需要科学合理的设计以及详细的研究。不能只是盯着制剂处方工艺不放,很有可能原料药的理化性质才是关键。尤其是对于难溶性药物,不仅晶型会影响到制剂的质量,常常固体的形态(晶胚)、粒径分布以及固有溶出等也是需要考虑的因素。在得到理想的原料药之后,就需要对制剂处方及工艺进行细致的研究。需要从辅料包材的选择、处方的筛选及工艺的优化等方面进行着手,与原研品进行杂质谱及溶出的详细对比,从而尽可能的向原研靠近,最终达到一致。
没有药学过硬的产品,想要顺利的通过BE,或许有些为难医生和受试者了。
参比制剂
合理的选择参比制剂是药学研究成败的关键。起初大家对参比制剂的选择也是无比的头痛,尤其是对改剂型的品种,更是无从找到自己的“兄弟姐妹”。但是,不用过于担心,总局考虑到大家的难处,定期公布了一些品种的参比制剂:
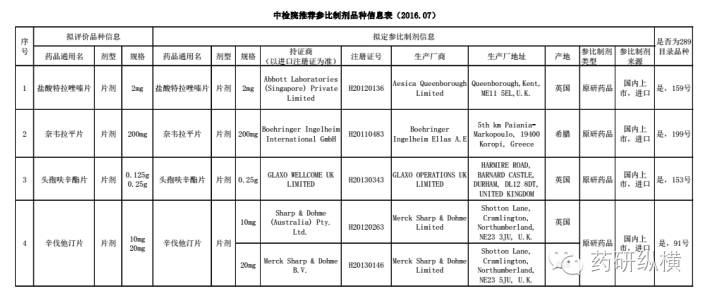

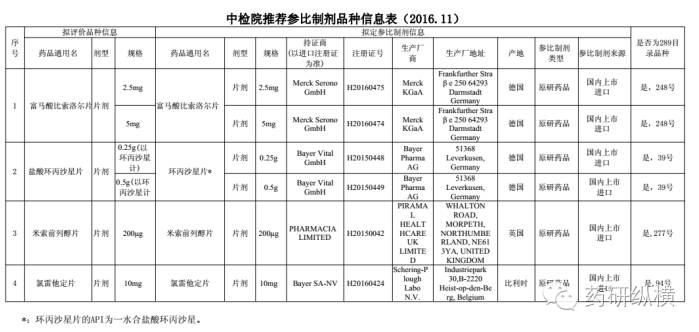
对于参比制剂,总局也公布了一些品种企业自行选择参比制剂的信息供大家参考,由于篇幅有限,这里就不一一列举了。
CRO公司
此次一致性评价,不仅对药品生产企带来一定的冲击,对于传统的CRO公司更是一次不小的打击。自从临床核查、快速审评之后,通过买卖临床批件获利的年代就一去不复返了。运气好的CRO公司,在2015年初将手中需要易手的临床批件顺利转手、成功逃顶,一些点背的生产企业成了最后的“接盘侠”。
有远见的CRO公司老总,早早下手去兼并药厂,为以后的可持续发展铺路。“上市许可人制度”的实施,也为CRO公司今后的发展指明了一条道路。还有一种方式,就是可以借鉴国外CRO公司的发展模式,从注重单一热门品种的开发转让,转向高精尖技术手段的突破及转让,也就是从卖品种转向卖技术。
结束语
总的来说一致性评价对药品行业及用药人都是有百利的,并且通过这样的过程,可以淘汰产能过剩及质量低劣的产品,也可以使得药品资源更集约化,更有利于国家的监管,从而保证药品高质量的可持续性。既然历史的车轮已不允许我们回头,那我们就改换理念,为成为医药强国努力前进。
以上为小编不成熟的一些观点,欢迎各位看官指正批
















