在2017年7月27日的那期Cell杂志上的Article一共是10篇,其中有4项研究成果的通讯作者是来自于中国的研究机构和高校,其中有篇还占据了本期封面。
这四篇论文分别来自中科院上海药物所徐华强团队(封面论文);浙江大学免疫所曹雪涛院士团队;清华大学颜宁团队;上海交通大学医学院附属仁济医院房静远、陈萦晅、洪洁、陈豪燕与美国密西根大学邹伟平合作团队。
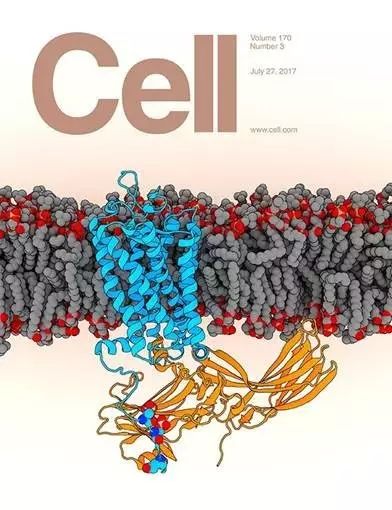
Cell封面图片:磷酸化视紫红质和阻遏蛋白复合物的高分辨率三维结构
蓝色所示为视紫红质的结构;黄色所示为阻遏蛋白的结构;灰色和红色球状结构为细胞膜磷脂;深蓝、蓝和红色小球所示为视紫红质的磷酸化氨基酸。

这篇封面文章延续了徐华强团队在2015年Nature上的研究,两者都是以G蛋白偶联受体(Gprotein-coupled receptor, GPCR)为目标。

GPCR是人体内最大的蛋白质家族,由800多个成员组成,在细胞信号转导中发挥非常关键的作用。此外GPCR是目前最成功的药物靶标,迄今40%左右的上市药物是以GPCR为靶点。GPCR对于细胞信号转导影响是通过下游G蛋白和阻遏蛋白两条主要的信号通路转导跨膜信号。
徐华强领衔的交叉团队在2015年Nature上的研究是利用X射线自由电子激光技术,发现了视紫红质与阻遏蛋白复合物的晶体结构。阻遏蛋白与GPCR的结合是协调整合GPCR下游信号网络的关键。
本次Cell上的研究更进了一步,不仅提供了视紫红质和阻遏蛋白复合物整体组装的结构信息,更重要的是破解了GPCR招募阻遏蛋白的磷酸化密码——GPCR通过其尾部氨基酸的磷酸化招募并与阻遏蛋白结合,同时发现该密码对整个GPCR蛋白组具有普遍性。
干扰素是一种非常有用的抗病毒药物,虽然存在严重副作用,但是许多医院还是把它作为治疗乙肝的常用药。目前对干扰素抗病毒的作用机制并没有完全了解,一般认为干扰素能够在病毒入侵时能调动多种细胞参与抗病毒免疫,从而激活机体的抗病毒能力。而如果干扰素信号调控异常,就会导致炎症性疾病、慢性感染性疾病发生发展。
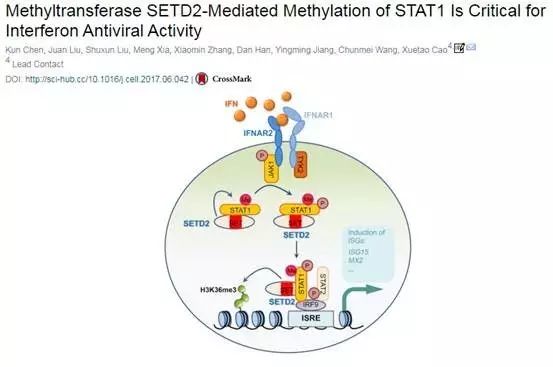
目前,我们用来治疗慢性乙肝的干扰素还是I型干扰素,效率低,疗效感人。曹雪涛院士通过高通量RNA干扰筛选发现,甲基转移酶SETD2可以放大IFNα介导的抗病毒效果,催化干扰素下游信号蛋白分子STAT1的甲基化,调动更多的细胞参与抗病毒反应,提升干扰素的疗效。另一方面,在肝细胞中SETD2的丢失会促进HBV感染,从而导致肝损伤。
机理上,SETD2通过在K525上直接甲基化STAT1来增强抗病毒免疫力。此外,SETD2选择性地催化H3K36对一些ISGs启动子的三甲基化作用,引发相关基因活化。
颜宁的又是一篇结构论文,在这项最新的研究里,首次报道了真核钠通道复合物Nav1.4-β1的冷冻电镜结构,整体分辨率达到4.0 Å。该蛋白来自于电鳗,其具有一个特化的肌肉组织称为电板,在受到刺激或捕猎时能够放出很强的电流。

电流产生的原理是钠通道的瞬时激活,因此该器官要富集钠通道,其序列与人源9个亚型中的Nav1.4最为接近,命名为EeNav1.4。研究人员用特异性的抗体从电鳗中提纯出了Nav1.4-β1复合物,获得了性质稳定且均一的蛋白样品,制备出优质的冷冻电镜样品,解析出了高分辨三维结构。

对,就是这个萌货
结肠直肠癌是全球发病率第三的常见癌症,也是导致癌症相关死亡的第二大原因。化疗失败一直是结直肠癌复发和预后不良的主要原因,这项研究发现,一种细菌与结肠直肠癌的复发和预后不良有关,肠道菌群对结直肠癌患者化疗耐药也有影响。
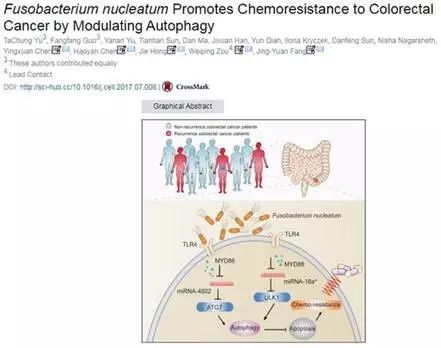
这项研究是由上海交通大学医学院附属仁济医院消化科的房静远教授、陈萦晅副教授、洪洁和陈豪燕副研究员以及美国密西根大学邹伟平教授联合发表在Cell上。通常情况下,化疗会诱导肿瘤细胞凋亡,但有些癌细胞能通过激活一种名为自噬的细胞存活机制,避免化疗引起的细胞凋亡。
其机理是,具核梭杆菌靶向TLR4和MYD88先天免疫信号和特定microRNAs,经此激活自噬途径,改变结直肠癌化疗反应。具核梭杆菌能整合Toll-like受体、microRNAs和自噬分子网络,通过测量与具核梭杆菌相连的这些通路,并靶向设计药物将能改善结直肠癌患者预后。
同时发表4篇Cell对于美国来说可能不是什么新鲜事,但要知道从1980年,中科院北京微生物所的陆德如、戴秀玉和王敖全在Cell上发表了题为“The transposition properties of Tn2 in E. coli”的文章之后的25年,中国学者再也没有在Cell上的发表过文章,直到2005年才有了第二篇。这种在CNS正刊上同时发表四篇主要为国内完成的论文的“刷屏”做法尚属首次,不过随着中国生命科学领域飞速发展,套用一句最近刷屏的话:不必过分在意,习惯就好。














