

摘要
:
苦参碱具有广泛的生物活性,如保护心、肝、肺、肾、脑、血管作用,对心脏有正性肌力、负性频率、抗心律失常作用,还有升高白细胞,平喘,抗溃疡,抗肝纤维化以及镇静、催眠、镇痛等中枢神经药理作用,也具有抗肿瘤、免疫调节、抗菌、抗病毒、抗炎等药理作用。其中抗肿瘤、心血管保护和治疗病毒性肺炎的药理作用的研究比较深入,希望生产企业开发苦参碱的这些新适应症。苦参碱是一种亲水性的弱碱性药物,易透过生物膜,口服和经皮给药易吸收和分布,约
50%
原型苦参碱经尿排泄。通过综述苦参碱药动学参数、体内过程,总结苦参碱的药动学研究进展,为合理用药提供参考。推荐将苦参碱试用于病毒性肺炎的治疗。
苦参碱(
matrine
)是一种天然生物碱,主要提取自豆科槐属植物苦参
Sophor flavescens
Ait.
、越南槐
S.tonkinensis
Gagnep.
、苦豆子
S.alopecuroides
L.
和白刺花
S.viciifolia
Hance
,被我国批准用作保肝药和免疫调节剂。由于苦参碱是苦参碱类生物碱中的典型代表之一,而备受关注。大量研究发现苦参碱具有广泛的生物活性,如抗菌、抗病毒、抗炎、免疫调节、抗肿瘤、保护心、肝、肺、肾、脑、血管作用,对心脏有正性肌力、负性频率、抗心律失常作用,还有升高白细胞,平喘,抗溃疡,抗肝纤维化以及镇静、催眠、镇痛等中枢神经药理作用
[
1-5
]
。其中对心血管保护、抗肿瘤和治疗病毒性肺炎的药理作用的研究比较深入,希望有关单位和企业开发苦参碱的这些新适应症。苦参碱是一种亲水性的弱碱性药物,易透过生物膜,口服和经皮给药易吸收和分布,约
50%
原型苦参碱经尿液排泄,综述苦参碱的药动学研究进展,为生产企业开发生物利用度高的新剂型和剂量准确提供依据,并为临床合理应用该药提供参考。
1
药动学参数
1.1
在人和猴体内的药动学参数
王平全等
[
6
]
报道
8
名男性志愿者静滴苦参碱
6 mg/kg
,
0.5 h
滴完后其药动学过程符合二室模型,血清中苦参碱的分布半衰期(
t
1/2α
)为
19.21 min
、消除半衰期(
t
1/2β
)为
184.22 min
、血药浓度时间曲线下面积(
AUC
)为
596.08 mg/
(
min·L
)、中央室表观分布容积(
V
c
)为
123.06 L/kg
、清除率(
CL
)为
2.75 L/
(
kg·min
)。
张瑞雯等
[
7
]
报道
9
例男性志愿者口服苦参碱胶囊
100
、
200
、
400 mg
后,
t
1/2β
分别为
8.68
、
8.28
、
7.82 h
、
AUC
分别为
6375.38
、
13047.49
、
20316.03
(
μg·h
)
/L
、分布容积(
V
)分别为
149.01
、
154.16
和
131.34 L
、
CL
分别为
16.88
、
16.98
、
21.24 L/h
、平均滞留时间(
MRT
)分别为
10.75
、
10.54
、
9.71 h
、达峰时间(
t
max
)分别为
1.33
、
1.61
、
1.67 h
。郑小林等
[
8
]
报道,采用
200 mg
苦参碱电子胶囊磁定位于志愿者的近端小肠内进行遥控近端小肠定点释药,结果发现近端小肠定点释放苦参碱的药动学符合二室开放模型,血浆中
t
1/2α
为
0.90 h
、
t
1/2β
为
9.02 h
、
AUC
为
91.90
(
mg·h
)
/L
、
t
max
为
2.08 h
、最大血药浓度(
C
max
)为
10.52 mg/L
,说明人小肠对苦参碱有明显的吸收,且吸收过程呈二室模型。
王素军等
[
9
]
给食蟹猴
iv
或
ig
苦参碱
10 mg/kg
,
iv
时的
t
1/2β
为
10.50 h
、
AUC
为
4.88
(
mg·h
)
/L
、
MRT
为
2.45 h
;
ig
时的
t
1/2β
为
11.2 h
、
AUC
为
2.04
(
mg·h
)
/L
、
MRT
为
1.99 h
、
t
max
为
0.17 h
、
C
max
为
1.30 mg/L
。
1.2
在犬、兔、大鼠、小鼠体内的药动学参数
已经有作者报道苦参碱给犬、兔、大鼠、小鼠
iv
、
ip
、
ig
、
im
或经皮给药的药动学参数
[
10-30
]
,见表
1
。其中罗学娅等
[
19
]
还报道兔
iv
苦参碱
40 mg/kg
后的
V
c
为
0.52 L/kg
、稳态表观分布容积(
V
ss
)为
2.44 L/kg
。而王晓红等
[
31
]
报道兔
iv
苦参碱
20
、
40 mg/kg
的
V
c
分别为
1.021
、
0.966 L/kg
。其中魏红等
[
21
]
还报道兔皮肤涂抹苦参碱乳膏
120 mg
,血清
t
max
延长至约
3 h
,但一经达峰便可维持较长平稳的血药浓度,在
3
~
7 h
内血药浓度保持在
21 mg/L
,说明苦参碱以零级动力学透过皮肤,经皮给药苦参碱在兔体内的绝对生物利用度达到
80.82%
。魏红等
[
30
]
又在小鼠的皮肤上涂抹苦参碱微乳
2.6 mg/
只,与
ip
苦参碱
2.6 mg/
只比较(表
1
),
t
1/2
、
MRT
、
AUC
值大大提高,血药浓度稳定持久,经皮给药
36 h
时血药浓度仍有
416μg/L
,而
ip 6 h
仅为
38 μg/L
。
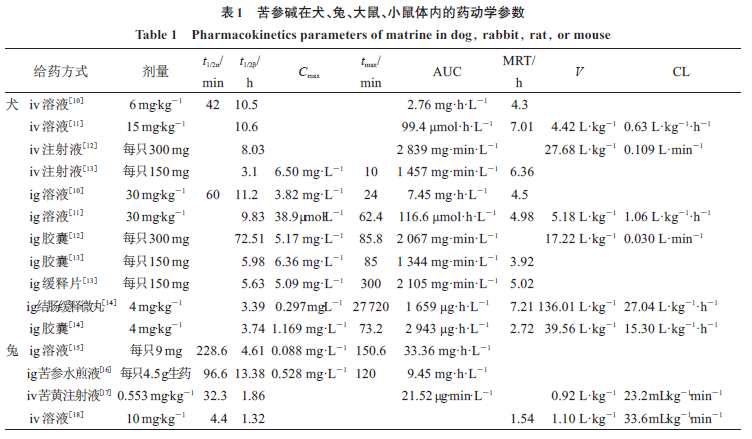
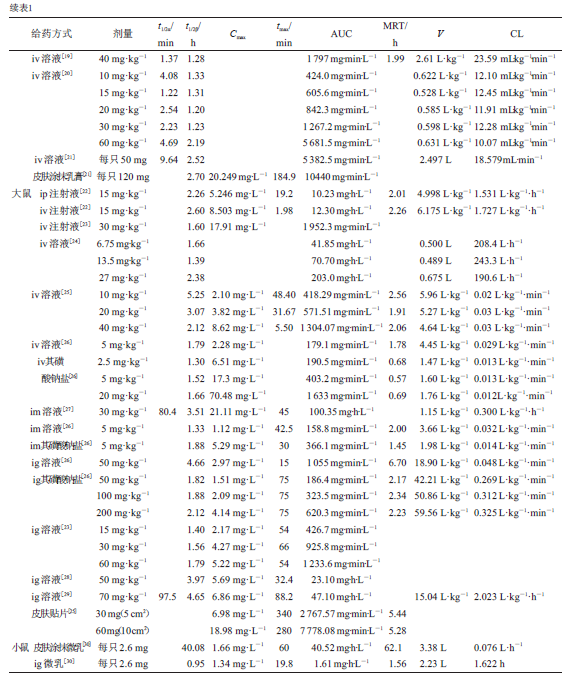
何治芬
[
25
]
还报道大鼠皮肤贴片苦参碱
30 mg/5 cm
2
或
60 mg/10 cm
2
的血浆
AUC
值是
iv
苦参碱
40 mg/kg
的
2
倍,
MRT
是
iv
时的
3
倍,而
C
max
水平二者相当,说明经皮给药低剂量(
30 mg/5 cm
2
)时能达到
iv
苦参碱
40 mg/kg
时的效果,且能维持较长时间,起到缓控释作用,值得推广于临床。
王平全等
[
28
]
给大鼠连续
21 d ig
苦参碱,与给药
1
次相比较,血清苦参碱浓度并不增加,这可能与其
t
1/2β
比较短有关。漆林艳等
[
29
]
还报道给大鼠
ig
苦参碱
70 mg/kg
的同时再
ig
甘草酸
70 mg/kg
,苦参碱的
C
max
降至
4.12 mg/L
、
AUC
降至
35.07
(
mg·h
)
/L
、
t
1/2α
延长至
3.335 h
、
t
1/2β
延长至
7.176 h
。甘草酸可能对苦参碱在大鼠体内的吸收、分布和消除有明显的影响。
苦参碱的饱和水溶液的
pH
值为
8.7
[
11
]
。其在水,
pH
值为
2
、
3
、
4
、
5
、
6
、
7
、
8
、
9
、
10
、
11
的磷酸盐缓冲液,甲醇,乙醇,正丁醇,正辛醇中的平衡溶解度分别为
70.26
、
116.97
、
96.48
、
74.14
、
72.25
、
70.03
、
72.04
、
69.71
、
55.86
、
55.85
、
55.23
、
870
,
16
、
675.21
、
662
,
54
、
507.79 g/L
;在上述
pH
值下的表观油(正辛醇)水分配系数(
lg
P
app
)分别为
0.001
、
0.001
、
0.196
、
0.052
、
0.313
、
1.182
、
2.652
、
4.216
、
6.314
、
8.690
,表明苦参碱既有亲水性又有亲脂性,在碱性条件下脂溶性较好
[
32
]
。杨建宏等
[
33
]
也报道了类似的的实验结果:苦参碱在
pH
值为
2
、
3.6
、
4.5
、
5.8
、
6.8
、
7.4
、
7.8
的磷酸盐缓冲液中的平衡溶解度分别为
137.14
、
117.23
、
113.50
、
115.00
、
116.00
、
113.07
、
111.90 g/L
,在上述
pH
值下的
lg
P
app
分别为
0.35
、
0.19
、
0.27
、
0.26
、
0.41
、
2.16
、
3.06
。刘晓东等
[
34
]
报道苦参碱在正辛醇缓冲液分配体系中的分配系数(
K
)为
4.48
,
K
值在
4
~
6
为最佳亲油亲水性质,提示苦参碱易透过生物膜屏障产生药理作用。
从王素军等
[
9
]
报道的药动学参数可以计算出食蟹猴
ig
苦参碱
10 mg/kg
的绝对生物利用度为
41.8%
。而犬
ig
苦参碱溶液
30 mg/kg
的绝对生物利用度分别为
60.1%
[
10
]
和
60.6%
[
11
]
。钱方等
[
12
]
报道给犬
ig
苦参碱
300 mg/
只的绝对生物利用度为
74.55%
。李晏等
[
13
]
报道犬
ig
苦参碱胶囊或缓释片
150 mg/
只的绝对生物利用度分别为
48.1%
和
73.5%
,缓释片的吸收较普通胶囊充分。祝经平等
[
23
]
报道大鼠
ig
苦参碱溶液
15
、
30
、
60 mg/kg
的绝对生物利用度分别为
43.7%
、
47.4%
、
31.6%
,说明苦参碱剂量增大到一定程度时吸收率会下降。刘青旺
[
26
]
报道给大鼠
ig
苦参碱溶液
50 mg/kg
的绝对生物利用度为
47.85%
,
im
苦参碱
5 mg/kg
的绝对生物利用度为
94.88%
;而
ig
或
im
相同剂量的苦参碱磺酸钠盐的绝对生物利用度分别为
4.6%
和
90.84%
,说明苦参碱磺酸钠盐
ig
吸收差。冯晓杰等
[
22
]
报道大鼠
ip
苦参碱注射液
15 mg/kg
的绝对生物利用度为
83.21%
。魏红等
[
21
]
报道苦参碱乳膏剂经兔皮给药的绝对生物利用度为
80.82%
。说明苦参碱注射给药和经皮给药吸收良好,且经皮给药可使血药浓度维持较长时间的平稳
[
20
,
30
]
。
庞志功等
[
15
]
报道
ig
苦参碱
9 mg/
只,在兔体内的吸收速率常数(
K
a
)为
0.7766 h
-
1
是消除速率常数(
K
10
,
0.167 4 h
-
1
)的
4.62
倍。杨云等
[
16
]
报道给兔
ig
苦参水煎液
4.5 g
生药
/
只,其中苦参碱的
K
a
为
1.632 h
-
1
是
K
10
(
0.0633 h
-
1
)的
25.77
倍,吸收半衰期(
t
1.2Ka
)为
0.425 h
。王平全等
[
28
]
报道给大鼠
ig
苦参碱
50 mg/kg
的
K
a
为
3.400 h
-
1
是
K
10
(
0.523 h
-
1
)的
6.50
倍,
t
1.2Ka
为
0.204 h
。漆林艳等
[
29
]
报道大鼠
ig
苦参碱
70 mg/kg
的
K
a
为
1.896 h
-
1
是
K
10
(
0.216 h
-
1
)的
8.78
倍,
t
1.2Ka
为
0.438 h
,如果同时
ig
甘草甜素
70 mg/kg
,甘草酸使苦参碱的
K
a
增大到
1.985 h
-
1
,
K
10
降低到
0.164 h
-
1
,
K
a
/
K
10
比值增大到
12.10
倍,
t
1.2Ka
降低到
0.277 h
,说明甘草甜素能促进苦参碱的吸收。与各自的
t
1/2β
相比,苦参碱是一类口服吸收快、消除较慢的药物(表
1
)。
张蕾等
[
35
]
采用苦参总碱在人结肠腺癌
Caco-2
细胞单层模型进行苦参碱的吸收试验,发现苦参碱在
Caco-2
细胞吸收方向(绒毛面到基底面)的表观渗透系数(
P
app
AP
→
BL
)为
1.098
×
10
-
5
cm/s
,分泌方向(基底面到绒毛面)的
P
app
BL
→
AP
为
1.104
×
10
-
5
cm/s
,表观渗透率为
1.01.
而张海等
[
36
]
报道苦参碱在
Caco-2
细胞的表观渗透率为
1.251
。
郑小林等
[
8
]
报道,采用苦参碱近端小肠定位释放胶囊证实人小肠是苦参碱口服吸收的主要部位。王平全等
[
28
]
采用大鼠胃肠道结扎法进行实验,发现每段分别给与苦参碱
2 mg
后大鼠胃、十二指肠和小肠的吸收率分别为
5.45%
、
78.17%
和
90.83%
。马小花等
[
37
]
采用大鼠在体单向肠灌流实验测得苦参碱
400 mg/L
在大鼠十二指肠、空场、回肠、结肠的
K
a
分别为
0.25
×
10
-
2
、
0.80
×
10
-
2
、
0.4
×
10
-
2
、
0.35
×
10
-
2
min
-
1
,空肠>回肠>结肠>十二指肠,但不同浓度苦参碱(
100
、
200
、
400 mg/L
)在空肠的
K
a
分别为
0.79
×
10
-
2
、
0.81
×
10
-
2
、
0.80
×
10
-
2
min
-
1
,不受浓度的影响。苦参碱
400 mg/L
在空肠的吸收表观渗透系数(
P
app
)为
0.90
×
10
-3
cm/min
,
P
-
糖蛋白抑制剂维拉帕米和有机阳离子转运蛋白抑制剂西咪替丁不明显降低苦参碱的
P
app
值,说明苦参碱不是
P-
糖蛋白和有机阳离子转运蛋白的底物,在各肠段都有吸收,其中在空场吸收最好,吸收机制可能是被动扩散吸收。
刘晓红
[
11
]
对苦参碱的吸收进行了深入研究:通过大鼠外翻肠囊和
Caco-2
细胞这
2
种肠吸收模型试验,均发现肠吸收苦参碱均因
pH
值升高而增强,胞饮抑制剂金刚胺、代谢抑制剂
2
,
4-
二硝基苯酚,均不影响
Caco-2
细胞对苦参碱的摄入,且摄入呈浓度相关地升高。由于加入钙离子络合剂
EGTH
后氧化苦参碱的渗透速率极显著增加,而苦参碱仅仅显著增加,说明二者均可由细胞旁路被动扩散吸收,其中氧化苦参碱的肠吸收以细胞旁路被动扩散为主,苦参碱的肠吸收以经细胞通路被动扩散为主,且二者的肠分泌不受
P-
糖蛋白外排的影响。各肠段给与苦参碱均能吸收,无特异性吸收部位。
P
app
不受苦参碱浓度的影响,吸收顺序为空场>十二指肠>回肠>结肠。何盛江等
[
38
]
采用翻转肠囊法测得苦参碱
300 mg/L
在小鼠十二指肠、空场、回肠的
K
a
分别为
0.010 2
、
0.010 4
、
0.009 8 min
-
1
符合一级吸收模型,与大鼠不同,不同肠段之间
K
a
无显著性差异,在小鼠肠道的
P
app
为
1.69
×
10
-
5
cm/s
,吸收促进剂卵磷脂、脱氧胆酸钠、聚山梨酯
-80
、泊洛沙姆仅轻度提高苦参碱的
P
app
,而十二烷基硫酸钠
0.2%
、
0.5%
和
1%
浓度均能提高
P
app
,分别为
3.36
×
10
-
5
、
3.27
×
10
-
5
、
3.20
×
10
-
5
cm/s
均约提高
1
倍,十二烷基硫酸钠以
0.2%
浓度为最佳。阮婧华等
[
39
]
采用大鼠三重在体单向肠灌流实验发现苦参碱在大鼠近端空场、中间小肠、远端回肠段灌流的肠
P
app
分别为
1.34
×
10
-
5
、
1.52
×
10
-
5
、
0.94
×
10
-
5
cm/s
;苦参碱自乳化纳米粒在上述肠段的
P
app
分别为
2.71
×
10
-
5
、
2.30
×
10
-
5
、
3.98
×
10
-
5
cm/s
;苦参碱
-
磷脂复合物自乳化纳米粒的
P
app
分别为
3.44
×
10
-
5
、
3.64
×
10
-
5
、
5.21
×
10
-
5
cm/s
,但乳糜流动阻断剂秋水仙碱能降低这
2
种自乳化制剂的
P
app
值,提示苦参碱自乳化制剂可通过肠淋巴通道增加苦参碱的吸收。
3
分布
刘晓东等
[
34
]
报道平衡透析法测得苦参碱的兔血浆蛋白结合率为
74.9%
。而王平金等
[
28
]
报道平衡透析法测得的大鼠血浆蛋白结合率仅为
19.34%
。董玲娜
[
40
]
采用超滤法测得的大鼠血浆蛋白结合率为
5.10%
~
10.55%
。唐意红等
[
41
]
报道苦参碱的人血浆蛋白结合常数为
8.838
×
10
3
L/mol
,与人血浆蛋白结合较弱,苦参碱浓度在
0.2
~
15.0 mg/L
时的血浆蛋白结合率为
17.2%
~
23.1%
,结合率与浓度之间呈负相关性。杨美玲等
[
42
]
报道苦参碱对人血清白蛋白和牛血清白蛋白均具有一定的荧光淬灭作用,在
37ºC
淬灭常数分别为
4.60
×
10
3
、
3.17
×
10
3
L/mol
,结合常数分别为
6.667
×
10
-
7
、
1.582
×
10
-
15
L/mol
,苦参碱与二者之间的结合为疏水作用,且为自发反应。
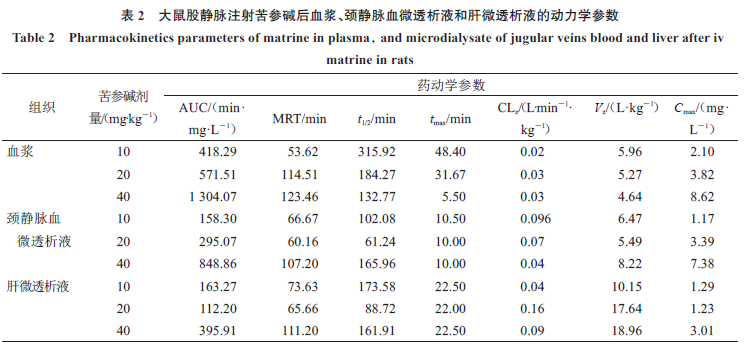
何治芬
[
25
]
报道了大鼠
iv
或皮肤敷贴苦参碱贴片后,采用微透析探针植入颈静脉腔、肝大叶或药物敷贴处的皮下即微透析法测定组织液游离态苦参碱的分布动力学参数,结果见表
2
、
3
。从表
2
、
3
的
AUC
值可见血液中游离态苦参碱约占血浆总苦参碱的
50%
,苦参碱贴片
30 mg/5 cm
2
组与
iv
苦参碱
40 mg/kg
组相比,血浆总苦参碱的
AUC
是
iv
组的
2
倍,肝脏中分布的游离态苦参碱也接近
iv
组的
2
倍,
MRT
是
iv
组的
3
倍,而血浆
C
max
水平
2
组相当,说明低剂量贴片(
30 mg/5 cm
2
)组已能达到
iv
苦参碱
40 mg/kg
的效果,且能维持更长时间,起到缓控释的作用。皮下微透析液中苦参碱的
AUC
很大,说明苦参碱贴片能稳定释放药物并被皮肤吸收,在皮下形成药物贮库,产生长效作用;也说明苦参碱在大鼠血液分布中约有
50%
是游离态的,游离态苦参碱在肝脏也有更高的分布。在
iv
苦参碱
10
、
20
、
40 mg/kg
时肝脏中游离态苦参碱的
AUC
分别占血液中游离态
AUC
的
87.05%
、
40.67%
、
47.49%
,占血浆中总苦参碱
AUC
的
33.18%
、
20.21%
、
31.14%
,而血液中游离态
AUC
占血浆总苦参碱
AUC
的
38.08%
、
52.78%
、
67.34%
;大鼠敷贴
30 mg/5 cm
2
和
60 mg/10 cm
2
苦参碱贴片,上述占比分别为
63.44%
和
44.20%
、
25.09%
和
25.58%
、
40.20%
和
62.48%
。
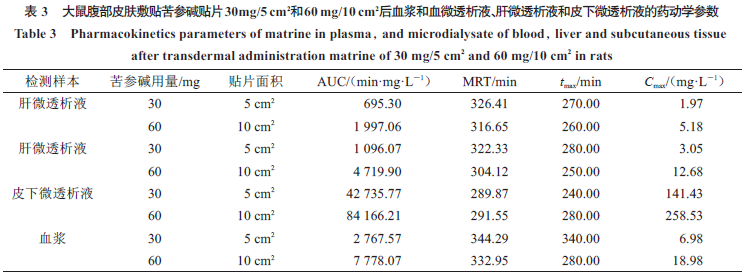
冯超等
[
43
]
采用离体肝
HepG2
细胞进行药物摄取实验,发现苦参碱浓度在
0.05
~
50 nmol/L
时
HepG2
细胞对苦参碱的摄取呈现良好的线性关系,药物浓度由
0.5 μmol/L
增加到
400 μmol/L
时苦参碱的摄取率显著下降。苦参碱可解离成有机阳离子,有机阳离子转运体抑制剂吡拉明、维拉帕米、奎尼丁和苯海拉明均能显著抑制
HepG2
细胞对苦参碱的摄取,说明苦参碱进入肝细胞以主动转运为主,其中多特异性有机阳离子转运体系统介导的摄取转运是主要途径。
罗学娅等
[
19
]
报道大鼠
ig
苦参碱
40 mg/kg
后
15
~
240 min
,组织中苦参碱含量以肾为最高,依次为肝、肺、脑、心、血,肾和肝中含量以
120min
时最高,肺、脑、心和血中含量在
60 min
时达高峰。王平全等
[
28
]
报道大鼠
ig
苦参碱
50 mg/kg
后
48 h
时大多数脏器仍能测得药物,苦参碱含量以肾为最高,依次为肝、脾、肺、脑、心、血,以上脏器药物含量均约在














