2017年6月20日,经FDA专家组讨论,建议诺和诺德(Novo Nordis)糖尿病药利拉鲁肽(Victoza)增加其说明书病症使用范围,继可以有效降低Ⅱ型糖尿病人患心血管疾病的风险,使利拉鲁肽成为既礼来(Eli Lilly)和勃林格殷格翰(Boehringer Ingelheim)的恩格列净(Empagliflozin)之后第二支具有该类功能的临床药物(图1)。
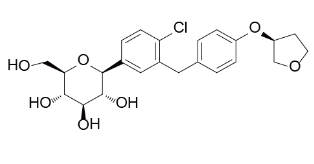
图1. 恩格列净(Empagliflozin)
利拉鲁肽是胰高血糖素样肽-1 (GLP-1)受体激动剂,于2010年1月25日获美国FDA批准上市,结合饮食调控、合理运动以及其他糖尿病药物联合使用来降低血糖,并且FDA不推荐利拉鲁肽单独作为治疗饮食和运动未能控制的糖尿病药物(图2)。

图2. 利拉鲁肽(Victoza)
经试验以及反馈的数据,专家组以17:2的最终结果,对利拉鲁肽在降低病人患心血管疾病风险的作用持积极肯定态度。试验显示,通过与安慰剂组对照利拉鲁肽可以降低主要不良心血管事件13%,降低心血管死亡22%,降低任何原因引起的死亡15%,降低晚期糖尿病肾病风险22%(图3)。
图3. Victoza(利拉鲁肽)
在委员会表决之前,FDA审评员已经发表了简报,表示对这些结果没有大的疑虑。程序上讲,FDA不必遵循专家组的建议,但是FDA通常都会循序专家组的建议。FDA审评员也指出通常需要两组临床试验共同证明药品适用范围的增加,特殊情况下FDA也可以仅依据一组试验得出结论,前提是该组试验数据足够可靠,可以支撑论点。
在FDA专家组会议上,专家对两个问题进行了表决,第一个问题:试验是否能够说明对Ⅱ型糖尿病人使用利拉鲁肽与心血管疾病无关联,第二个问题:利拉鲁肽能够降低心血管疾病风险。专家组通过不记名方式对第一个问题给出了肯定的答案。
利拉鲁肽在2016年为诺和诺德带来29.8亿美元的销售额,并且跻身全球糖尿病药销售前十名。诺和诺德表示,新的说明为医师在开具处方时提供了全新的指导方案(图4)。

图4. 2016年全球糖尿病药物销售TOP10
利拉鲁肽的适应症拓展也许对诺和诺德来说是一剂强心脏,毕竟公司最近因美国政府通过控制药价对其糖尿病特许经营权施压而不得不裁员1000人。
参考:
1.FDA panel supportscardiovascular indication for Novo’s diabetes drug Victoza.
2.FDA Briefing Document:Endocrinologic and Metabolic Drugs Advisory Committee Meeting (EMDAC).
3.Novo Nordisk's diabetes medVictoza chops cardiovascular risks by 13%.
4.Top 10 diabetes drugs by 2016sales.
5.HIGHLIGHTS OF PRESCRIBINGINFORMATION Victoza® (liraglutide [rDNA origin] injection), solution forsubcutaneous use Initial U.S. Approval: 2010.
6.https://www.pharmacodia.com/