本文中有8组Fig,可以分成4部分:
Fig1通过细胞进行lncRNA分子的筛选验证,最后发现了起重要作用的lnc-DILC分子。
Fig2-Fig4通过离体和在体的实验证实了lnc-DILC与肿瘤干细胞(CSC)之间的关系。
Fig5-Fig7作者开始研究DILC下游的分子信号通路。
Fig8中对DILC的临床意义进行了研究。
由于肿瘤干细胞在肿瘤组织中的含量也很少,作者要进行筛选就必须在肿瘤干细胞和非肿瘤干细胞中进行一个差异比较。肿瘤干细胞有两大特性,一是自我更新能力;二是对化疗药物抵抗的能力。
作者采取了3株肝癌细胞系:Huh7、HepG2和CSQT-2,对这3种肝癌细胞系采取了2种培养方式,第一种培养方式就是普通培养,这样的条件下,肝癌细胞呈现出了一种贴壁生长、粘附生长的特性。这类都是非肿瘤干细胞的特性,如何获得肿瘤干细胞呢?
作者用了干细胞的一种化疗药物抵抗的能力,在培养基中加入了顺铂。对于非肿瘤干细胞来说,有杀灭作用,剩下的就是肿瘤干细胞。而且肿瘤干细胞还有自我更新的能力可以不断分裂。这样作者就既有非肿瘤干细胞,又有肿瘤干细胞,通过mRNA和lncRNA的嵌合芯片比较了有显著差异的mRNA和lncRNA分子。

作者在结果里挑选了一个lncRNA的分子,叫lnc-DILC(lncRNA down-regulated in liver cancer stem cells)。通过验证发现,这个分子在粘附细胞中表达很高,在肿瘤干细胞中表达非常低。
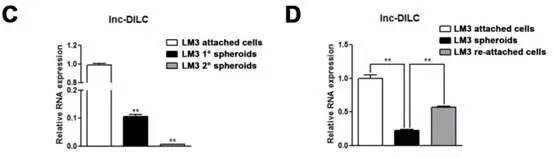
在肿瘤培养基中撤掉化疗药物顺铂,就会导致肿瘤干细胞缺少筛选压力,分化成非肿瘤干细胞,获得粘附表型。Fig1这两个实验说明了DILC的表达高低与肿瘤干细胞干性呈明显负相关。
Fig2中作者继续研究DILC与肿瘤干细胞之间的关系。在细胞内敲减DILC之后发现,EpCAM 和CD24这两个肝癌肿瘤干细胞的marker会显著增高。
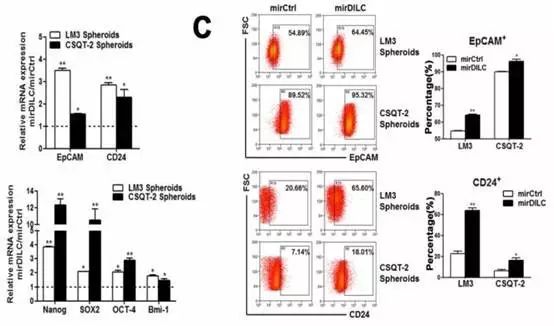
另外还有Nanog、SOX2、OCT-4、Bmi-1这4个和肿瘤干细胞相关的转录因子都会在DILC被敲减后,表达水平明显升高。在做了流式细胞检测后,还发现,在敲减了DILC之后肿瘤干细胞的比例也会有所增加。
在微球形成过程中敲减DILC,形成微球的数量明显增加;过表达DILC的话,则效果相反。
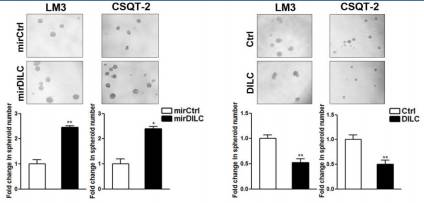
通过Fig2说明的就是DILC在肿瘤干细胞中的表达量会明显减少,在非肿瘤干细胞中DILC的表达量会明显增加。DILC的表达高低与肿瘤干细胞的数量呈反比关系。
在Fig3中用了一个在体的动物模型证实了DILC和肿瘤干细胞负向调控的关系。
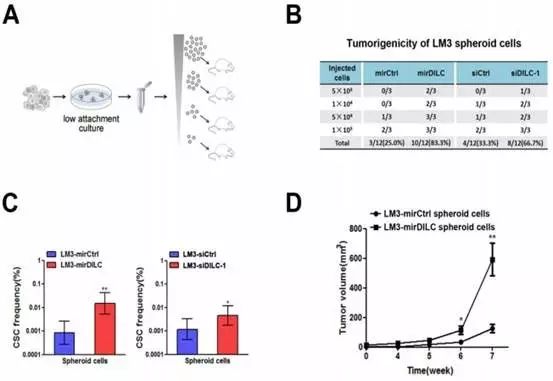
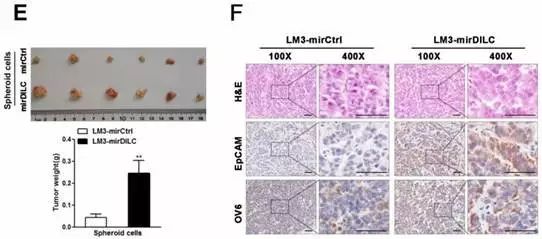
作者在收集了肿瘤干细胞之后,做了梯度稀释,按照不同的浓度比例接种到动物身上看成瘤率。统计结果显示,在对照情况下,肿瘤干细胞成瘤率大约是1/4~1/3,但是敲减了肿瘤干细胞中的DILC表达后,可以使成瘤率大幅度提高。Fig3C、D两张图也证实了DILC表达被敲减后,肿瘤干细胞占比会显著提升,形成肿瘤的体积也会显著增加。
通过前面的离体细胞实验和在体动物实验证实了DILC和肿瘤干细胞存在明显的负相关性。表型验证完后,作者开始研究下游的信号通路。作者用了PCR array的方式筛选了多条信号通路,结果发现其中一条JAK2/STAT3信号通路发生了显著变化。
Fig4A通过WB证实了DILC下游可以影响JAK2/STAT3信号通路。DILC表达升高抑制了JAK2/STAT3信号通路,表达下降,促进了JAK2/STAT3信号通路。
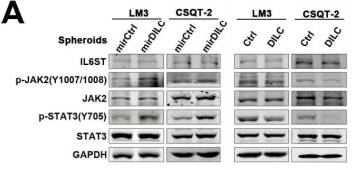
Fig4C通过免疫荧光实验证实了DILC和STAT3之间的关系,如果敲减了细胞内的DILC,发现STAT3的荧光会有所增强,且和DAPI共定位的STAT3增加的更明显。
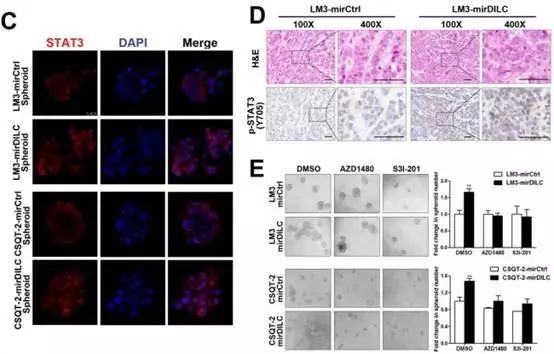
在Fig4E中,作者又通过在微球实验中阻断JAK2/STAT3信号通路发现,DILC确实是通过JAK2/STAT3信号通路来影响微球形成。
之前的实验说明了DILC调控了JAK2/STAT3信号通路,而在之前也有文献报道,IL-6也能调控JAK2/STAT3信号通路。那么这两者之间是什么样的调控关系呢?
Fig5A、B告诉我们DILC也能调控IL-6。Fig5A中在细胞内敲减DILC的表达后,可以明显的促进IL-6的表达。Fig5B中敲减了DILC之后IL-6的分泌增加,过表达DILC后,IL-6分泌明显减少。它们也是一个负向调控关系。
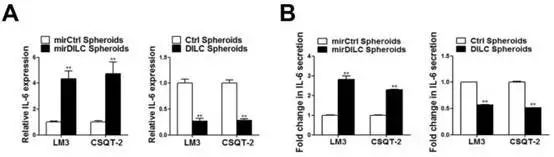
在Fig5D微球形成实验中,用单抗阻断了IL-6的受体,敲减DILC后微球并不会增多。说明DILC要促进微球形成,依赖于IL-6信号通路。
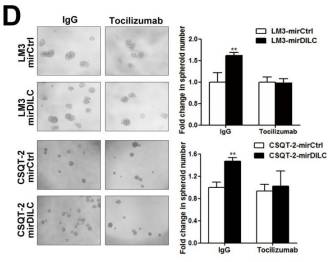
Fig5E通过在体的移植瘤模型,作者采用了免疫组化实验证实敲减DILC表达后使的下游的IL-6表达明显上升。整个Fig4、5就证实了DILC可以负向调节JAK2/STAT3信号通路和IL-6信号通路。
那DILC是如何负向调控IL-6的呢?作者发现,DILC和IL-6的启动子区域有一段序列是可以完全反向互补。这就提示了DILC也许可以结合在IL-6的启动子区来达到负向调控的表达效应。
为了验证这个假设,作者做了如下实验,作者先合成了一段反义寡聚核苷酸链。将这段反义序列结合到DILC上,获得了大量的富集的DILC序列。
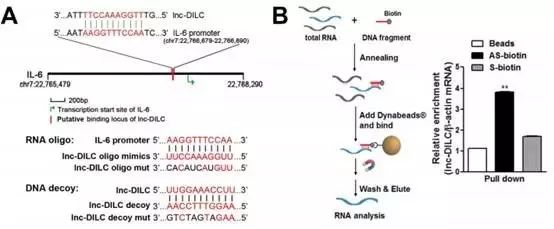
同时作者还做了与DILC序列完全一样的oligo mimics,结合到IL-6的启动子区域,负向调节IL-6表达。
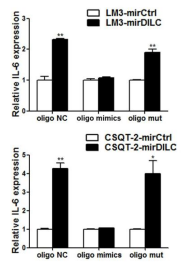
另一条Decoy序列则是与DILC完全反向互补,在过表达DILC的同时过表达Decoy的话也可以阻断DILC的下游效应。
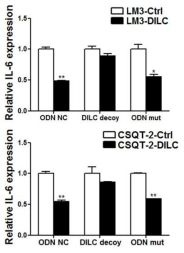
整个Fig6就是研究了DILC对IL-6调控的具体机制——DILC可以结合在IL-6的启动子区域。
在很多文献中都证实,NF-κB也能结合在IL-6的启动子区域,同样可以影响IL-6的表达。作者想知道DILC和NF-κB之间是否也有调节的关系?
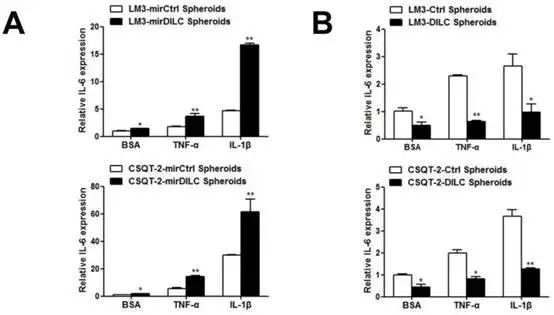
结果发现,NF-κB与DILC之间有一个竞争性结合IL-6,并调控IL-6表达的一个效应。
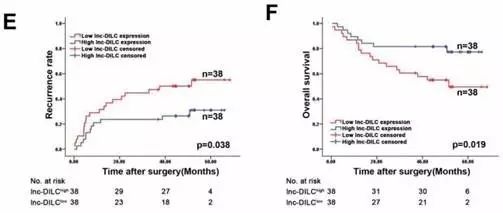
最后Fig8中,作者在临床样本中检测了DILC表达水平的高低,以及其临床意义。
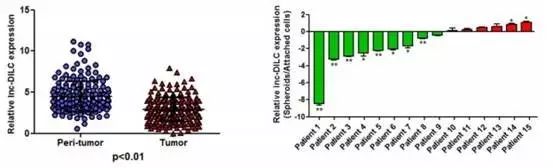
通过表达研究发现,DILC在肿瘤组织中的表达,比在癌旁组织表达低。对患者预后随访进行统计发现,如果患者的DILC表达很低,就表明肿瘤干细胞的干性强,未来发生复发的概率就比较高;总生存率也更低。