今年8月2日,Nature杂志在线发表了美国俄勒冈国家灵长类动物研究中心Shoukhrat Mitalipov领导的合作研究团队完成的题为“Correction of a pathogenic gene mutation in human embryos”的重要研究论文,利用CRISPR-Cas9 基因组编辑技术修正了未被植入子宫前的人类胚胎中一种和遗传性心脏疾病有关的变异,并进一步证实编辑人类生殖细胞系(卵子、精子或早期胚胎)的DNA是安全有效的(详见BioArt此前的报道:【黄军就点评】科学狂人Nature发表编辑人类胚胎成果)。
然而,面对人类胚胎基因编辑这一热门和极富争议的研究方向,英国科学家自然也不甘示弱。这不,9月20日,来自英国Francis Crick研究所由Kathy K. niakan领导的研究团队同样在Nature杂志上以长文形式(Article)发表了相关的研究成果,该论文题为“Genome editing reveals a role for OCT4 in human embryogenesis”。当然了,Shoukhrat Mitalipov领导的团队所做的工作主要是关注CRISPR-Cas9 基因编辑技术用于修正人类致病基因,而Kathy K. niakan领导的这项工作重点关注的是运用CRISPR-Cas9 基因编辑技术研究OCT4在人类早期胚胎发育中的作用(下图)。

OCT4是维持哺乳动物多能干细胞自我更新非常重要的转录因子,在小分子化合物诱导成纤维细胞重编程为iPS细胞过程中,OCT4也是四个Yamanaka因子中最难用小分子化合物替代的转录因子。关于OCT4在小鼠早期胚胎发育过程中的作用此前已经有很多研究,然而它在人类早期胚胎发育过程中的功能目前仍然知之甚少,并且OCT4在人类早期胚胎发育中的作用和在小鼠中有何明显差异也不是很清楚。
在这项研究中,研究人员运用优化过的CRISPR-Cas9 基因编辑技术对人类受精卵中的OCT4基因进行了靶向敲除(研究中使用的人类受精卵是来源于捐赠用于不孕治疗的多余人类受精卵)。研究发现,人类受精卵中敲除OCT4之后囊胚期的发育受阻,胚外滋养外胚层(extra-embryonic trophectoderm)表达的基因下调(例如CDX2),包括NANOG在内的外胚层多能性调节基因的表达也下调。然而,相比之下,在小鼠早期胚胎中敲除OCT4基因之后,受精卵能正常发育至囊胚阶段,但是NANOG基因在囊胚阶段仍然能够正常表达。这些结果充分显示了OCT4基因在人类和小鼠早期胚胎发育过程中的作用差别是非常大的,说明了OCT4在人类早期胚胎发育的更早期起关键作用。
当然这项研究同时也表明了运用CRISPR-Cas9 基因编辑技术研究人类早期胚胎发育过程是一个很有效的方法,而且在胚胎基因组激活(embryo genome activation)之前并不会造成基因组不稳定以及发育的阻滞。另外,这项研究也并没有解决为何在人类早期胚胎发育过程中敲除OCT4之后,受精卵为什么不能正常发育至囊胚阶段。
总的来说,这项研究看上去似乎并没有所谓太多“新意”,这样的稀缺工作可能由于种种原因导致其它的科学家能够去做但是不敢去做,但是做这样的工作还是非常令人关注的,也很清楚的告诉我们人类和小鼠在胚胎发育的早期阶段是有很大差异的。
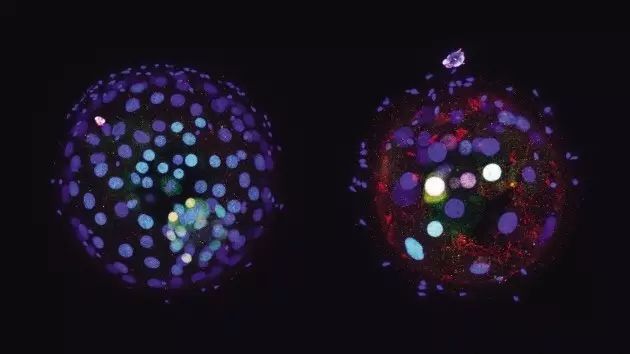
图片来自Nature。
Nature同时也刊发了相关的评论文章,并且给予了高度评价,称这项工作“ opens up a new era of human functional genetics”(下图)。



BioArt,一心关注生命科学,只为分享更多有种、有趣、有料的信息。关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:fullbellies或邮箱:[email protected]。














