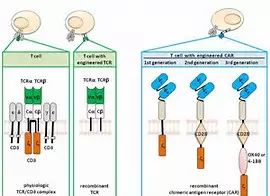
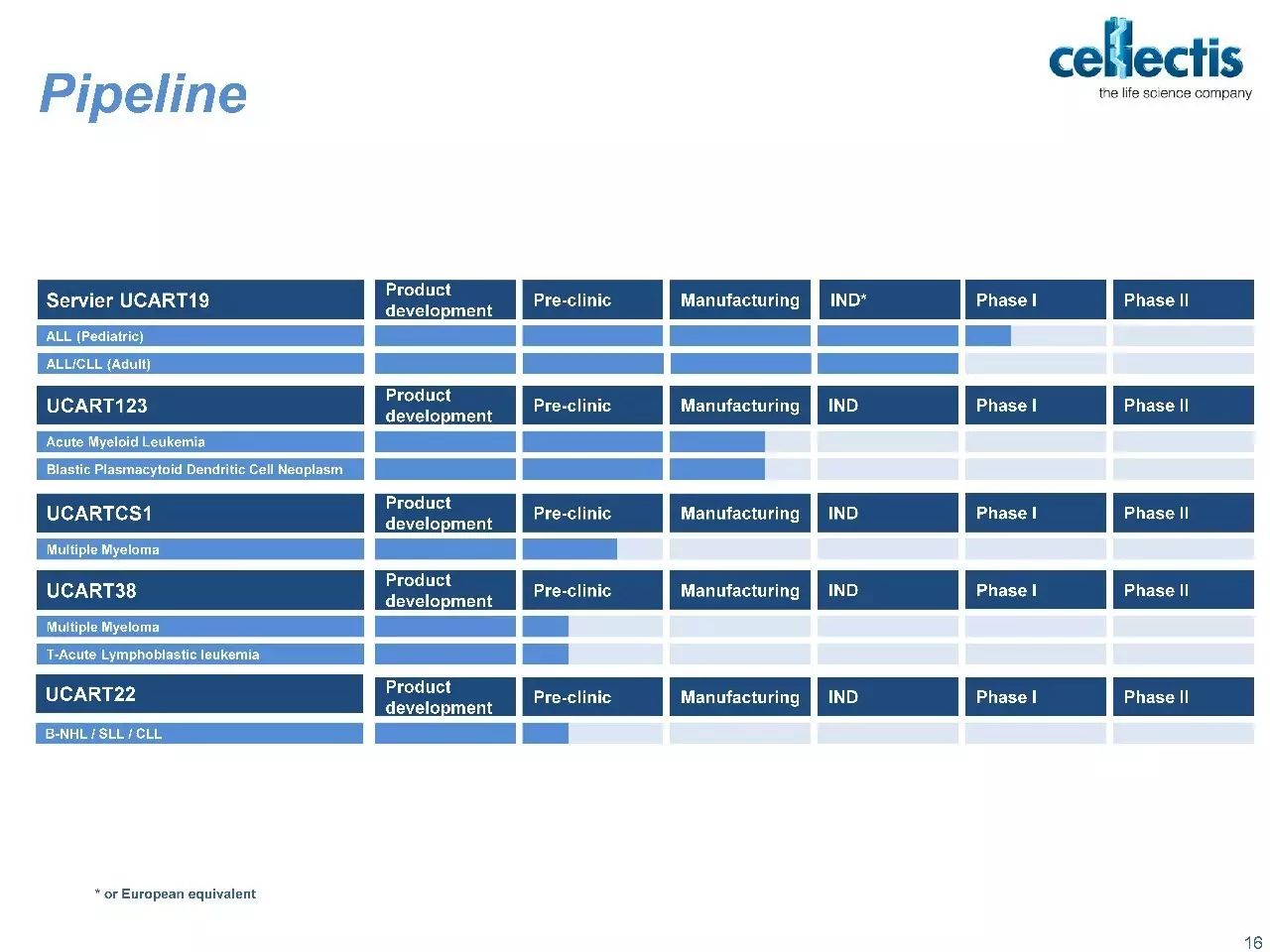
从事基因工程技术研发的生物制药公司Cellectis公司宣布其通用型CAR-T疗法UCART123获得了美国FDA的批准,进入临床试验。这也是第一款获美国FDA批准进入临床试验的此类产品。
Cellectis公司的这种新药与其他肿瘤免疫疗法的差异在于:前者不需要依据患者进行相应修饰。Cellectis公司的执行副总裁David Sourdive在声明中说:"以往的细胞疗法都属于自体移植范畴,而基于Talen 的基因编辑方法,使得细胞疗法的适用性得以扩展到一个人群,而不仅仅局限于单个个体,从而能够实现工业化大规模生产。

Engineered CAR-T Therapies





参考资料:
[1] Cellectis preps for groundbreaking UStrials for an off-the-shelf CAR-T therapy
[2] Cellectis (CLLS) Says FDA Grants INDApproval to Proceed with Clinical Development of UCART123
(来源:抗体圈 2017-05-28)
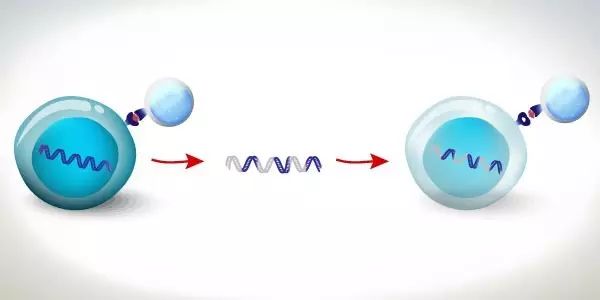
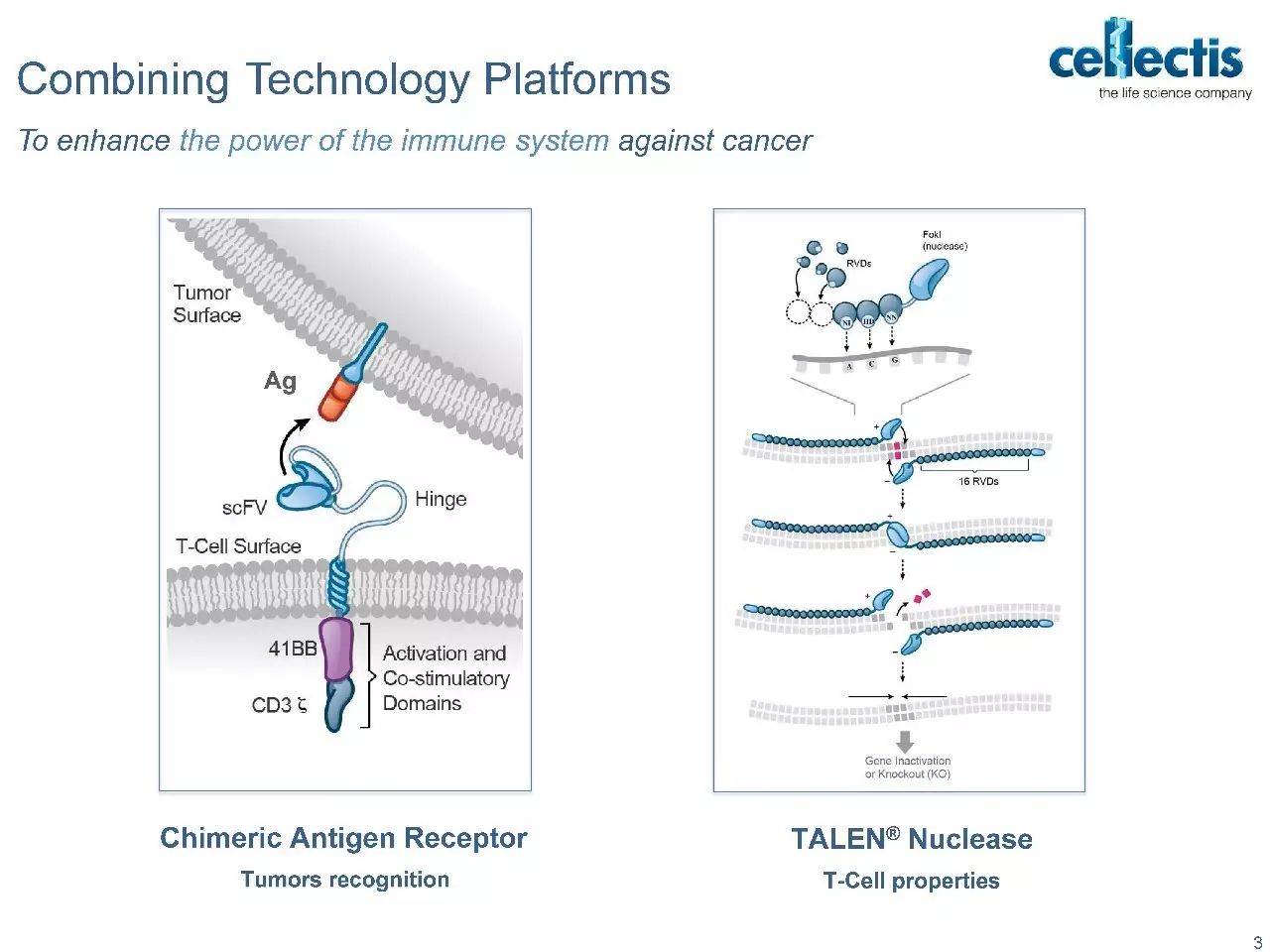
非病毒方式获得即用型CAR技术
DegasStealth™ Immune-Compatible Cell Systems
Progenitor DegasStealth™ Technology employs non-viral methods to disrupt the function MHC-I without eliminating its cell-surface expression enabling production of immune-compatible cell lines, that can be used for development of heterologous off-the-shelf cell therapies. DegasStealth™ cells additionally employ a DNA landing pad for generating isogenic daughter cell lines, and can be used as the basis for producing MonetTM functionalized cells that enable next generation immunotherapy constructs and workflows.
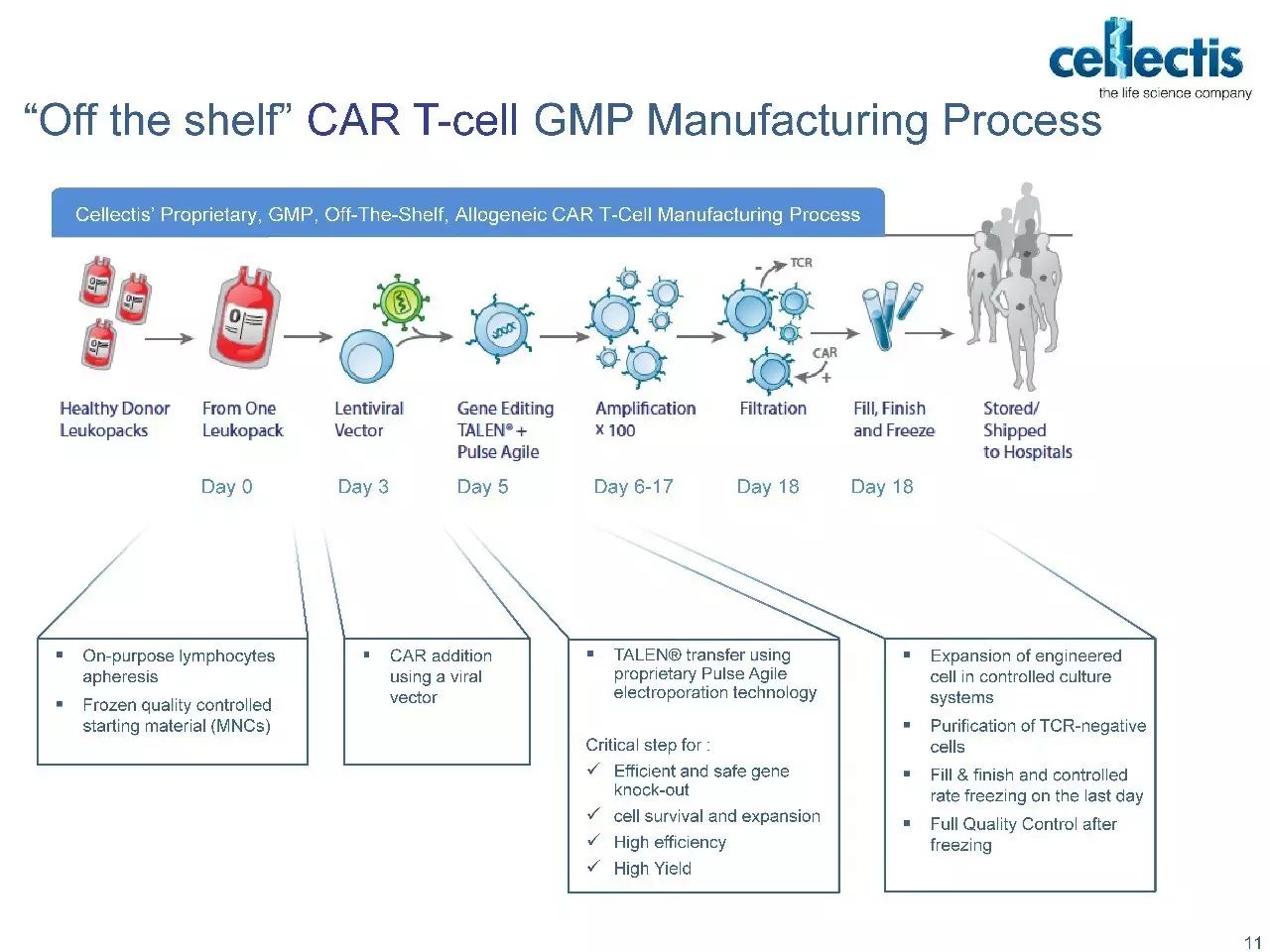
目前在CAR-T治疗中最好的办法仍是收集患者自身的免疫细胞,体外改造后再回输到患者体内。这种完全个性化的治疗方式导致CAR-T疗法的成本很难降低,而且很有可能延误治疗。为了使CAR-T疗法保持可行性,有必要降低自体疗法的成本,开发新的同种异体“的即用型(off-the-shelf)”疗法
在off-the-shelf的治疗方法中,来自健康供体的同种异体细胞在集中的设施中经历了工业规模化生产,产生了一种在输注前需要最少时间准备的即用型产品,从而使广泛的分配成为可能。
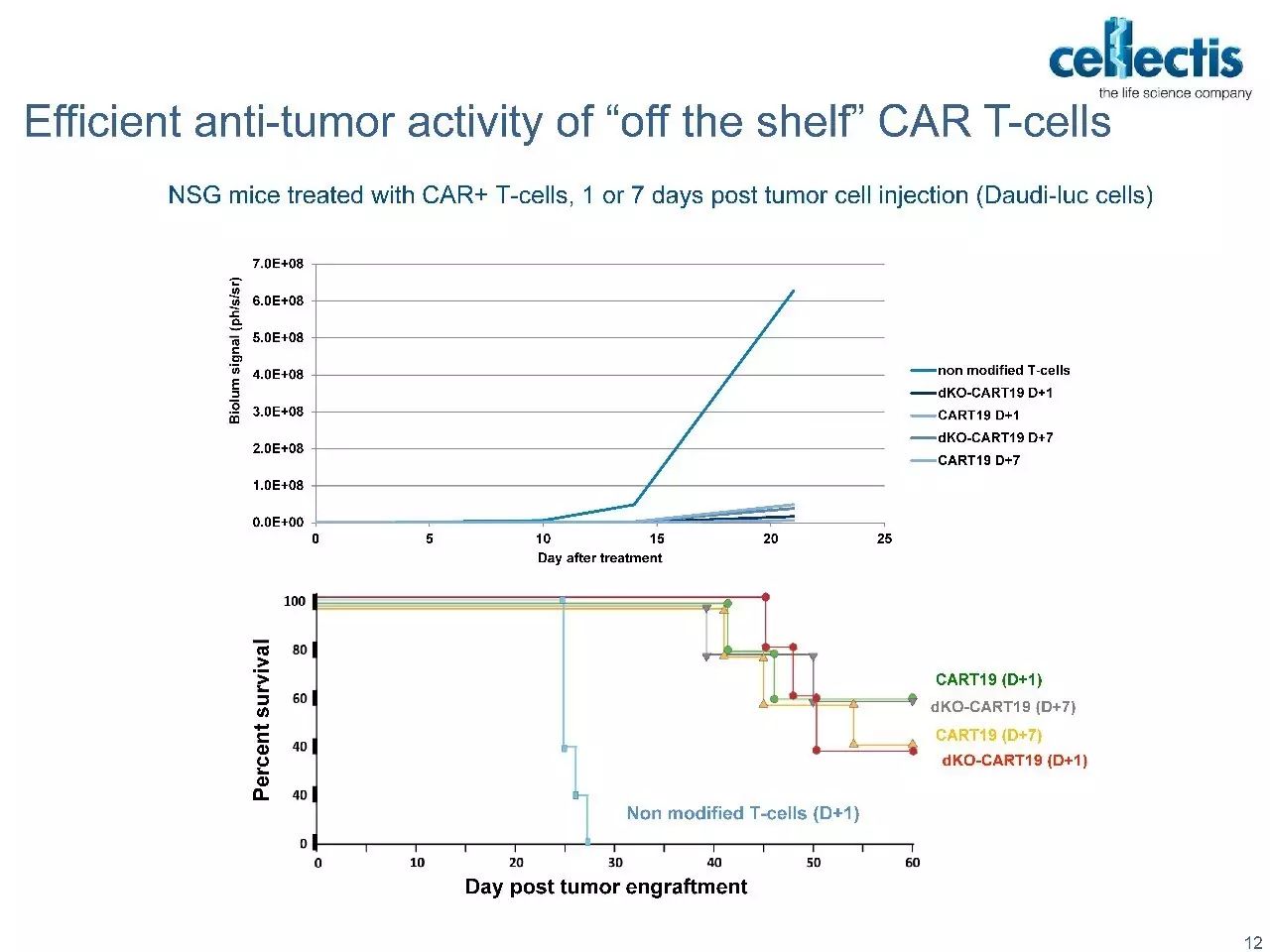
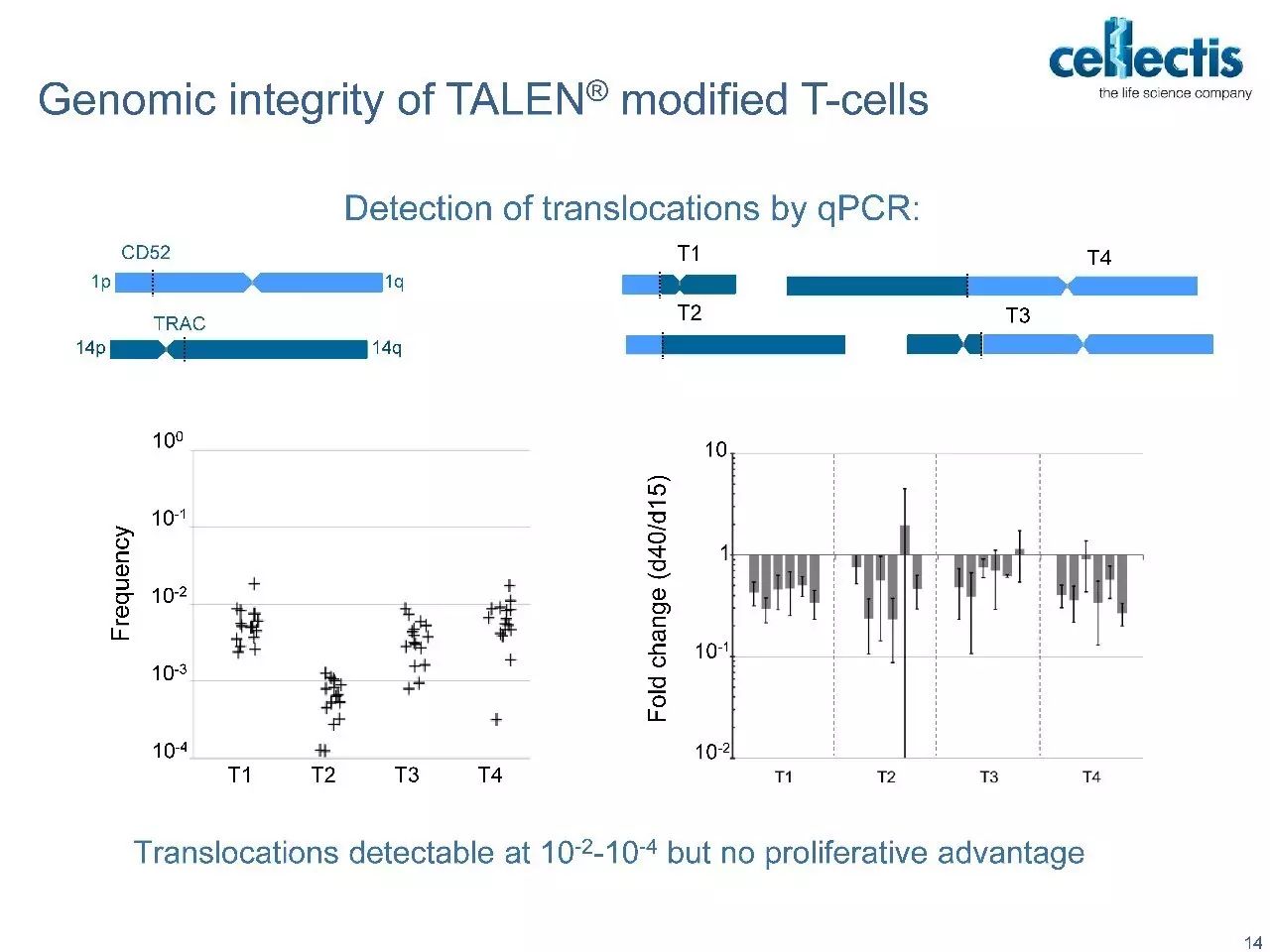
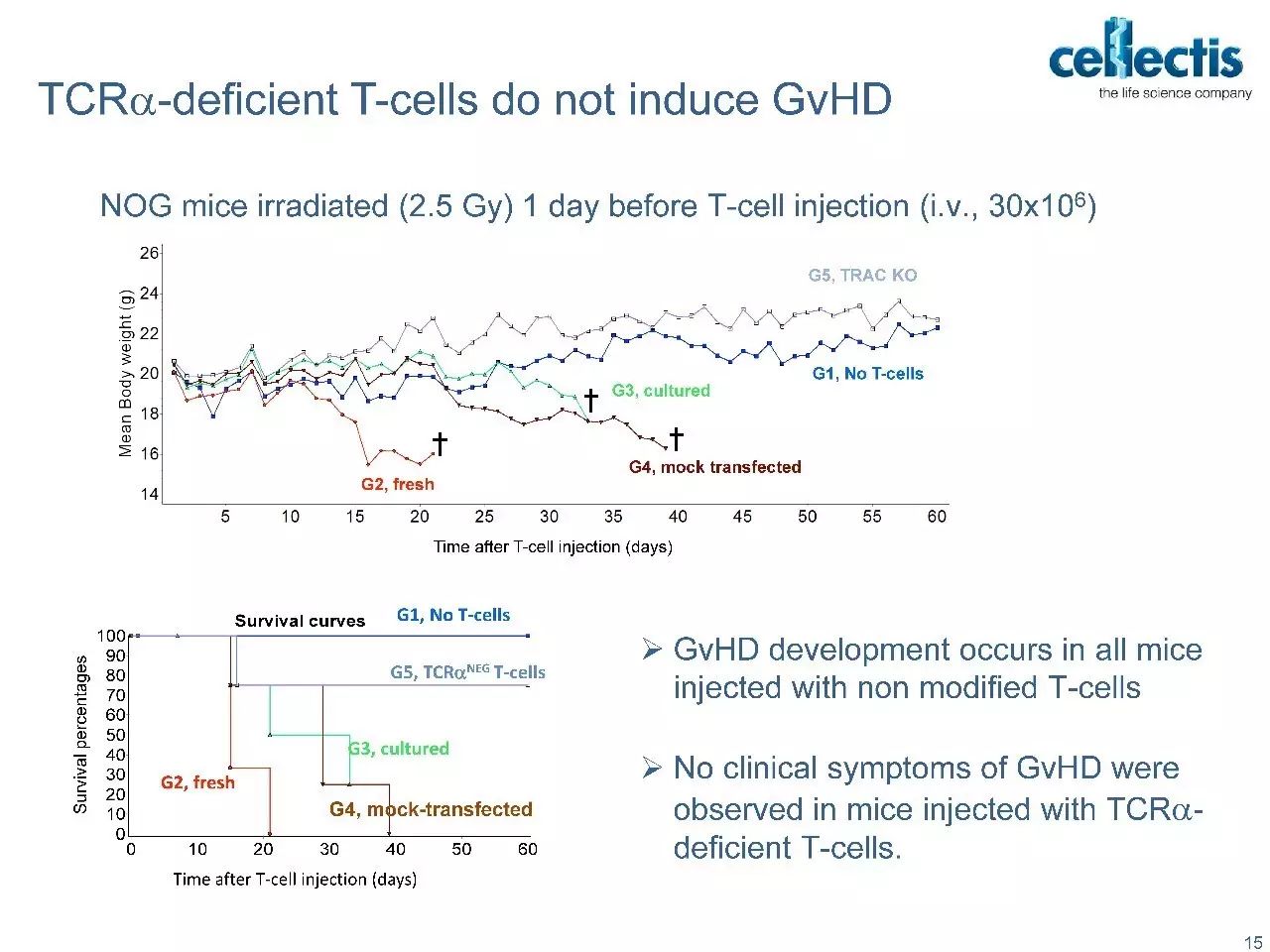
但“off-the-shelf”同种异体疗法一直存在着一个障碍,那就是供体细胞和受体之间的HLA匹配和交叉分型的成本问题。HLA不相容的细胞通过受体细胞毒性T细胞(CTLs)触发MHC-I介导的破坏。
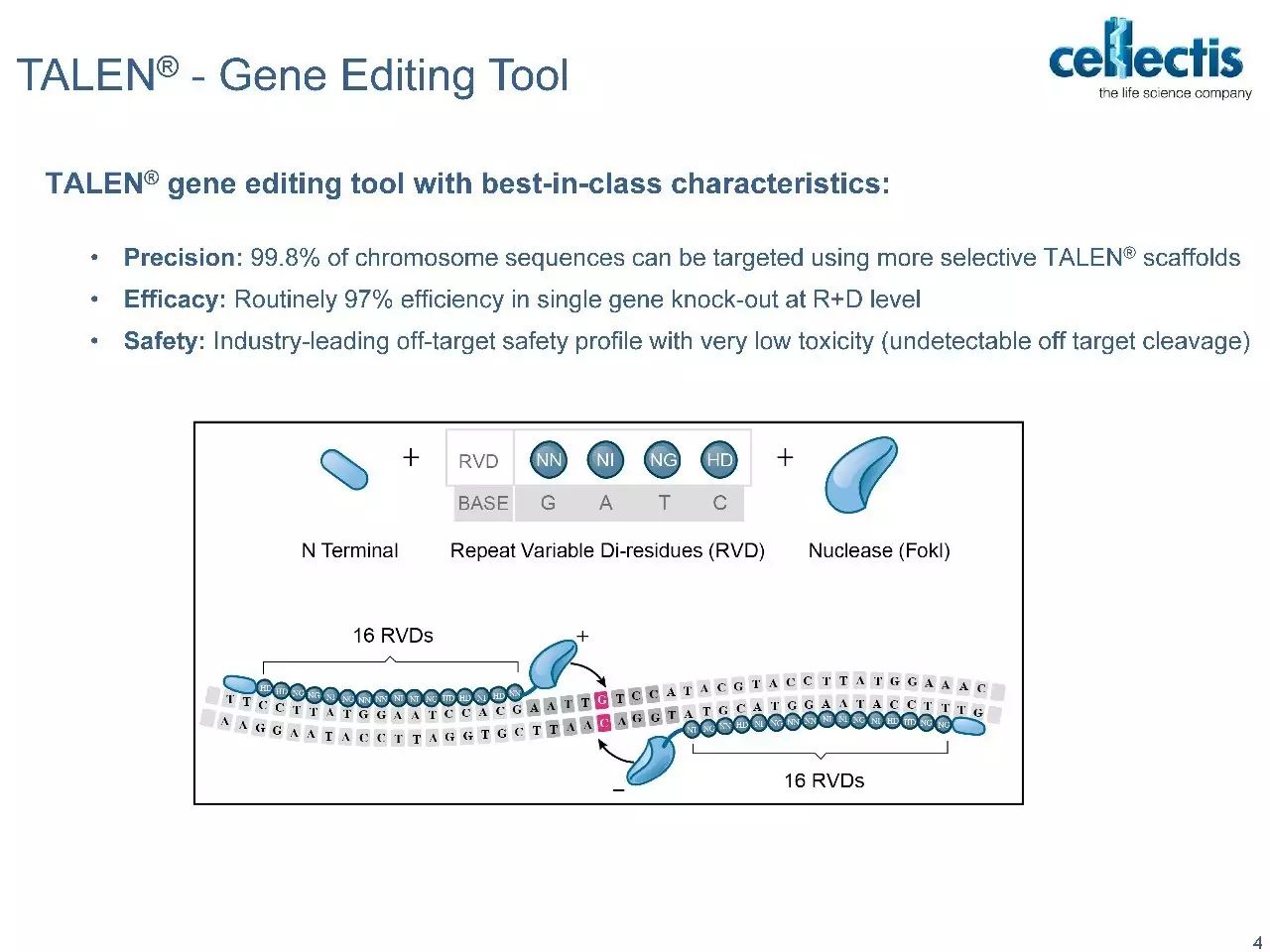
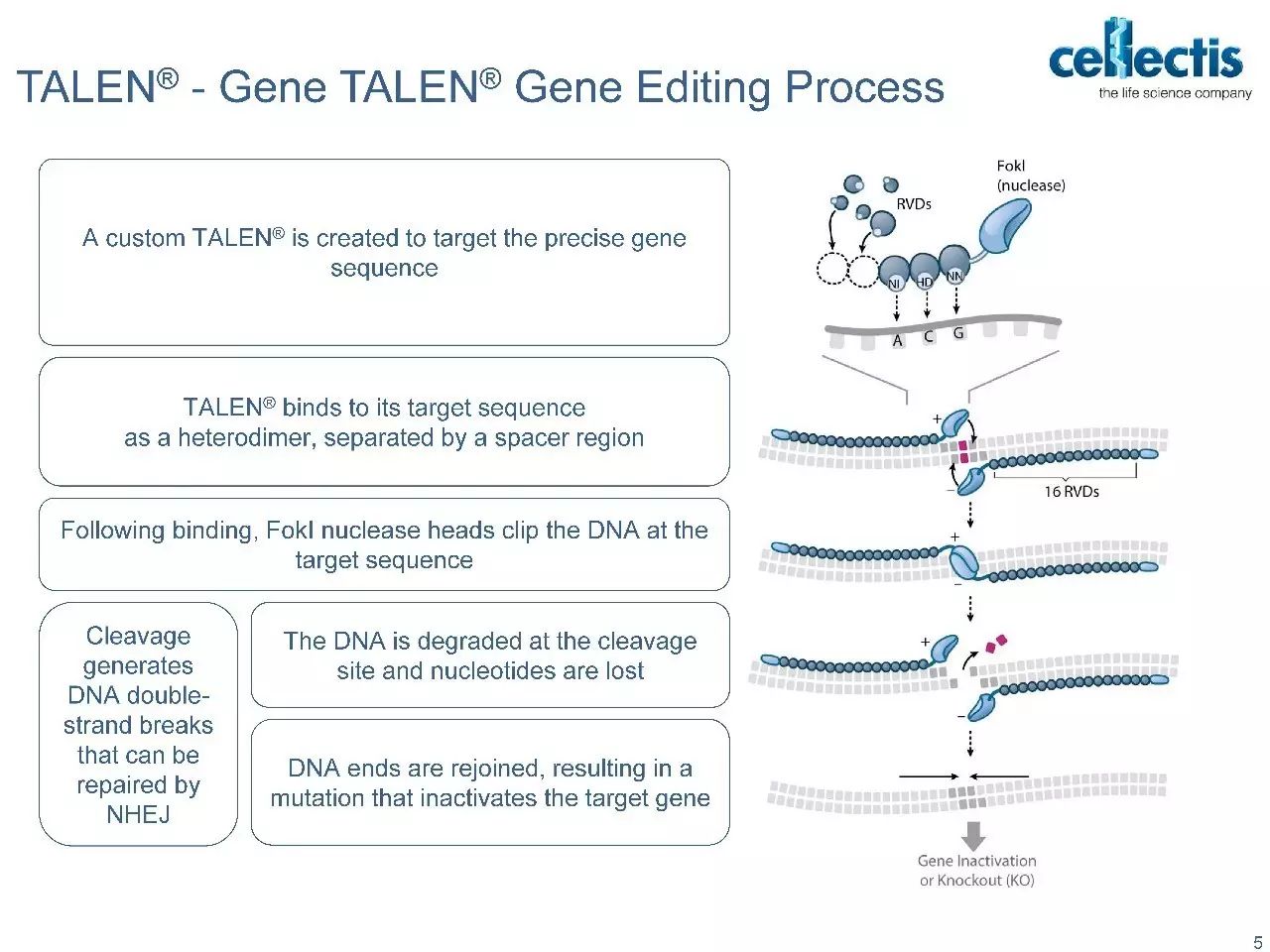
Progenitor DegasStealth™技术采用非病毒方法来破坏MHC-1的功能,同时不消除其细胞表面的表达,从而能够生产免疫相容性细胞系,避免了受体CTL反应和由缺乏细胞表面MHC-I引发的NK细胞介导的“missing-self”反应。可用于开发异源“off-the-shelf”的细胞疗法。 DegasStealth™细胞还采用DNA着陆垫产生等基因子细胞系,可用作生产能够实现下一代免疫治疗结构和工作流程的Monet™功能化细胞的基础。
https://progenitorlifesciences.com/technologies/degasstealth/
(摘自: 医麦客 2017-05-28)















