
本文转载自 BioArt。
自身免疫性疾病是一类机体对自身抗原发生免疫反应而导致自身多器官、组织受累的慢性炎症性疾病。目前大量研究表明机体内促炎症的TH17细胞和抑制炎症Treg细胞在类群数量和活化状态的失衡是造成自身免疫疾病的主要致病因素。尽管目前关于Hippo信号通路在对免疫缺陷和自身免疫有一些相关报道,然而对于Hippo信号通路在调控T细胞分化过程中的作用机理方面尚缺乏深入地研究。
5月15日,细胞信号网络协同创新中心、细胞应激生物学国家重点实验室、厦门大学生命科学学院陈兰芬教授和周大旺教授研究团队在Nature immunology杂志上以封面论文(Cover story)形式发表题为“The transcriptional coactivator TAZ regulates reciprocal differentiation of TH17 cells and Treg cells”的研究论文,该研究揭示了Hippo 信号通路转录共激活因子TAZ在决定CD4+初始T细胞分化为促进炎症的TH17效应细胞和抑制免疫反应的Treg调节性细胞过程中发挥着关键作用,拓展了当前对于Hippo信号通路的相关研究内容。
此外,该工作还被Nature Reviews Rheumatology杂志作亮点评论,BioArt也有幸邀请到了上海市免疫学研究所资深研究员/上海交通大学特聘教授李斌老师撰写了相关评论。据悉,这是周大旺教授和陈兰芬教授团队回国后在Nature immunology杂志上发表的第二篇封面论文,特别值得一提的是上周该团队还在Cancer Cell杂志上发表重要文章揭示了肝癌形成的重要机制。
1论文解读
自身免疫性疾病是一类机体对自身抗原发生免疫反应而导致自身多器官、组织受累的慢性炎症性疾病,如克罗恩肠炎、类风湿性关节炎和干燥综合征等。目前大量研究表明机体内促炎症的TH17细胞和抑制炎症Treg细胞在类群数量和活化状态的失衡是造成自身免疫疾病的主要致病因素(下图)。
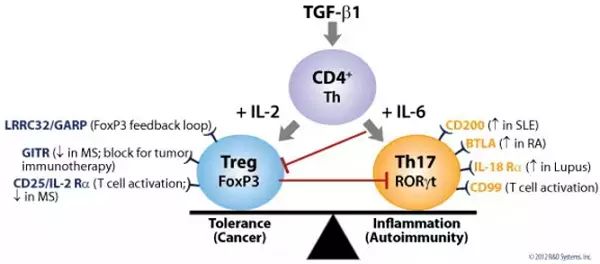
图片引自:Bonnevier, J., Guerra, A., & Goetz, C. (2013). Identification of novel cell surface markers on mouse and human TH17 cells (P6354). The Journal of Immunology, 190(1 Supplement), 199-3.
陈兰芬教授和周大旺教授团队的前期研究发现小鼠中Hippo信号通路中激酶Mst1/2缺失导致免疫缺陷,机体易受病原体感染并伴随着严重自身免疫疾病。随后,法国与德国研究人员发现一种人类家族遗传性的免疫缺陷及自身免疫病综合征是由于Mst1(STK4)基因功能缺失突变造成的(Abdollahpour et al., Blood,2012;Nehme et al., Blood,2012);2014年复旦大学陶无凡教授课题组也报道了Mst1/2缺失导致免疫缺陷(Du et al., The Journal of Immunology,2014)。2015年,陈兰芬教授和周大旺教授研究团队发现Mst1/2缺失导致吞噬细胞的线粒体无法募集到吞噬体周边导致损伤性ROS产生缺陷,从而导致机体病原体杀伤能力下降的重要机理(下图)(Geng et al., Nature immunology,2015,封面文章)。

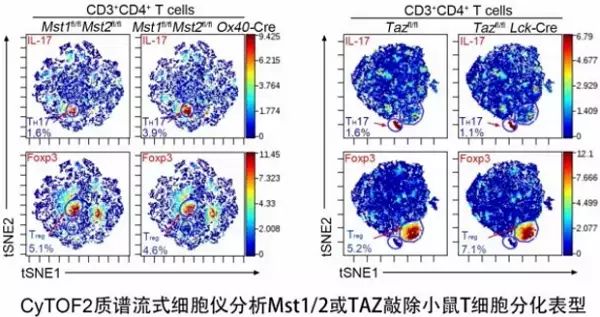
在这项研究中,该团队应用CyTOF2质谱流式细胞仪,针对Hippo信号通路关键成员在T细胞特异性敲除小鼠,利用KLH模型分析发现,与野生型小鼠相比Mst1/2敲除后TH17细胞亚群数量显著上升与之相对应的Treg细胞亚群大量减少;而当被Mst1/2抑制的下游效应分子TAZ敲除后,这两类亚群细胞数量呈现相反的变化。进一步研究发现CD4+初始T细胞分化为促进炎症的TH17效应细胞过程中TAZ表达显著上调,更重要的是通过分析类风湿性关节炎和干燥综合征病人的外周血记忆性T细胞后发现,TAZ与TH17细胞的核心转录因子RORgt的表达呈正相关。这说明TAZ的大量表达对于促进TH17细胞的分化及其介导的炎症性疾病的发生十分重要。
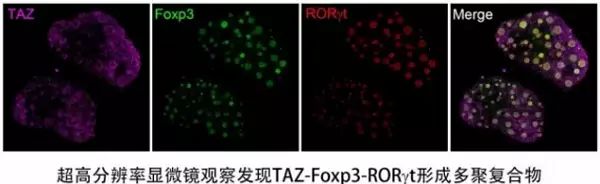
针对TAZ在TH17细胞培养分化条件下被诱导表达的现象,他们进行了深入的研究发现诱导TH17细胞分化的两大信号IL-6和TGF-β下游的转录因子Smad3和STAT3协同促进TAZ基因的转录和表达。利用超高分辨率显微镜GE OMX V4观察和生化手段验证后发现,多聚化的TAZ能够同时与TH17细胞的核心转录因子RORgt和Treg细胞关键转录因子Foxp3形成复合物(下图),TAZ能够促进RORgt转录活性但抑制Foxp3的功能,从而促进TH17细胞的分化和减弱Treg细胞的产生。
颇为有趣的是,他们发现初始T细胞分化为Treg细胞时,Hippo信号通路下游主要转录因子TEAD1的表达量明显上升,并且与RORgt、Foxp3或TEAD1相比TAZ与TEAD1具有更高的亲和力,从而阻断了TAZ与RORgt或Foxp3的相互作用,继而增强了初始T细胞分化为Treg细胞的能力。同时通过小鼠模型和细胞体外分化发现,当缺失TAZ或过表达TEAD1后,可以大幅提高初始T细胞分化为Treg细胞的能力,然而在初始T细胞中过表达TAZ,特别是突变与TEAD1作用位点的TAZ突变体后,能显著增强其分化为TH17细胞的能力。
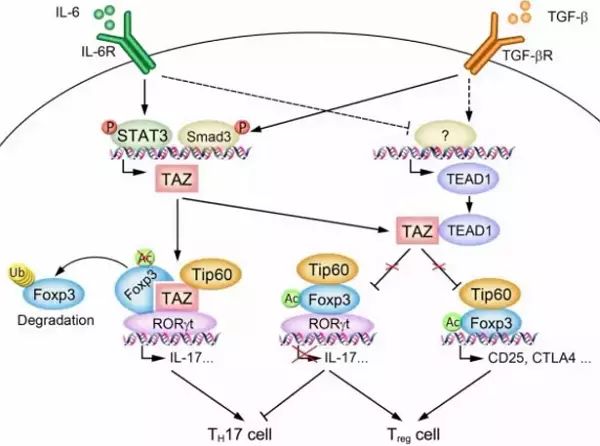
TAZ调控TH17细胞和Treg细胞分化的机理示意图
本项研究阐明了TAZ在调节CD4+初始T细胞分化为TH17细胞和Treg细胞的过程中发挥着关键调控作用和重要机理。该项研究对多种自身免疫性疾病的发病机理提供理论依据,也为早期诊断和治疗慢性炎症性疾病提供可能的分子标志物和治疗靶标。
据悉,本篇论文的主要工作由博士后耿晶、博士生余淑娟、赵昊和孙秀峰等学生共同承担,并与厦门大学附属第一医院、浙江大学、美国德克萨斯大学等单位合作完成,通讯作者为陈兰芬教授和周大旺教授。该研究工作获得了国家自然科学基金委、国家重点基础研究发展计划(973)项目、青年千人计划和中央高校基本科研基金的资助。
2专家点评
李斌 (上海市免疫学研究所资深研究员,上海交通大学特聘教授,国家“杰青”)

Comments:FOXP3阳性调节性T细胞(FOXP3+ Treg)与RORgt 阳性炎性效应性T细胞(RORgt+ Th17) 分化发育与功能平衡对维持机体免疫稳态,控制机体炎性反应至关重要,其分子机制涉及到决定Treg免疫抑制功能的关键性转录因子FOXP3与决定Th17促炎性因子分泌功能的关键转录因子RORgt的相互作用和调节。陈兰芬老师与周大旺老师的该项新研究发现了调节FOXP3与RORgt功能平衡的一个关键性转录共激活因子TAZ。其在Treg/Th17平衡中的作用,通俗来说,类似于蜀国(TAZ)的联吴(RORgt)抗曹(FOXP3)。TAZ在Treg/Th17平衡中的功能有可能独立于其先前已知的在Hippo信号通路中的经典功能。深入研究其上游调节信号通路,可能会对有关Hippo信号通路研究领域的拓展很有启发意义。另一方面,在某些组织特异性Treg细胞,如肠道中还发现FOXP3+RORgt +双阳性的诱导型Treg, 在这些细胞中FOXP3与RORgt功能还有相互协调作用。深入研究TAZ在不同组织特异性Treg及Th17细胞分化及功能的差异性,也会有重要的生理意义。
3陈兰芬教授简介

陈兰芬,博士,厦门大学生命科学学院教授。1993-2000年厦门大学本科和硕士、2001-2006年爱因斯坦医学院博士、2007-2012年哈佛大学医学院博士后;2013年获得国家"青年千人计划"资助、2015年获得国家基金委"优秀青年基金项目“资助、特聘为福建省“闽江学者”教授。长期从事炎症和免疫疾病发生,以及肿瘤发生发展的分子机制和功能研究,近五年以通讯作者在Cancer Cell、Nat Immunol、Nat Commun、Cell Rep等期刊上发表多篇研究论文。
参考资料:1)Abdollahpour, H., Appaswamy, G., Kotlarz, D., Diestelhorst, J., Beier, R., Schäffer, A. A., ... & Engelhardt, K. R. (2012). The phenotype of human STK4 deficiency. Blood, 119(15), 3450-3457.
2)Nehme, N.T. et al. MST1 mutations in autosomal recessive primary immunodeficiency characterized by defective naive T-cell survival. Blood 119, 3458–3468 (2012)
3)Du, X., Shi, H., Li, J., Dong, Y., Liang, J., Ye, J., ... & Xu, T. (2014). Mst1/Mst2 regulate development and function of regulatory T cells through modulation of Foxo1/Foxo3 stability in autoimmune disease. The Journal of Immunology, 192(4), 1525-1535.
4)Geng J, Sun X, Wang P, Zhang S, Wang X, Wu H, Hong L, Xie C, Li X, Zhao H, Liu Q, Jiang M, Chen Q, Zhang J, Li Y, Song S, Wang HR, Zhou R, Johnson RL, Chien KY, Lin SC, Han J, Avruch J, Chen L*, Zhou D*.Kinases Mst1 and Mst2 positively regulate phagocytic induction of reactive oxygen species and bactericidal activity. Nature Immunol. 2015. (Cover Story)
















