
高全立教授
:
过继性细胞治疗(ACT)在2016年魏则西事件后便一蹶不振。其实,并不应该将其完全否定。
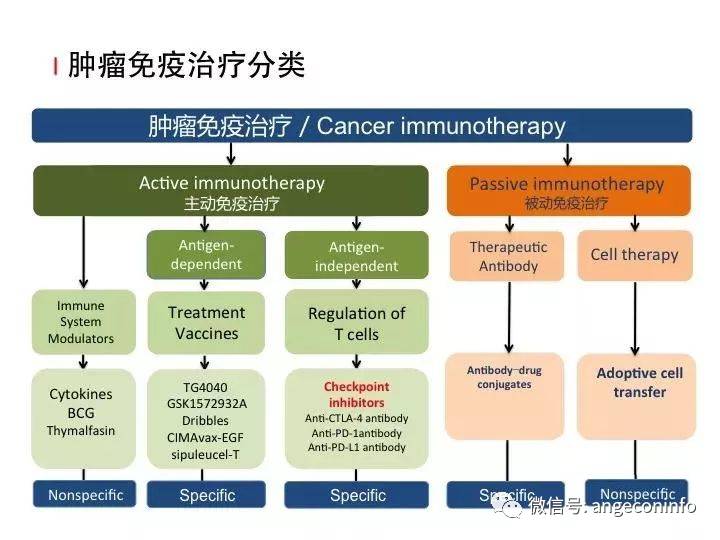
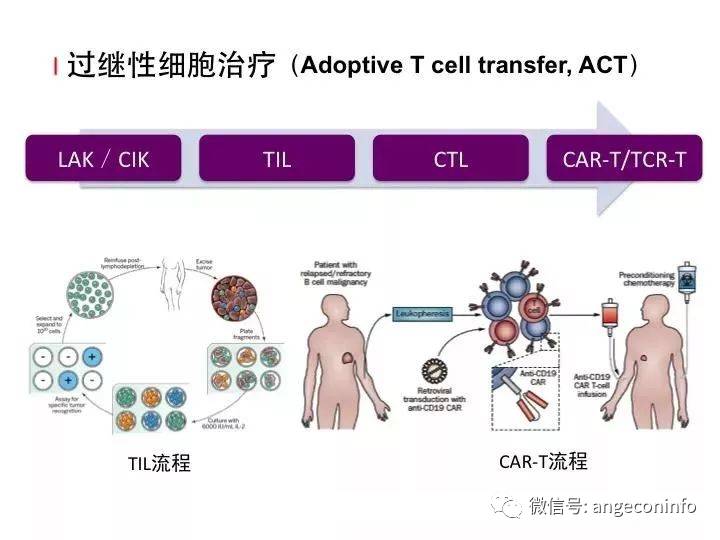
过继性细胞治疗种类繁多,包括自然杀伤细胞(NK)、CD3单抗和IL-2活化的外周血T淋巴细胞(CD3AK)、细胞因子诱导的杀伤细胞(CIK)、CTL、树突状细胞(DC)、肿瘤浸润淋巴细胞(TIL)、嵌合抗原受体T细胞(CAR-T)治疗及转染TCR基因的T细胞(TCR-T)治疗等。其中最为成功的是CAR-T细胞治疗血液肿瘤。
目前,免疫细胞治疗首先在晚期肿瘤中获得突破,包括:
-
FDA已批准两款CAR-T细胞药物用于难治复发白血病和淋巴瘤的治疗。
-
Provenge是一款以DC为基础的治疗性疫苗,FDA于2010年批准其用于内分泌治疗失败的晚期前列腺癌。但这款药物疗效有限,仅能延长病人4.1个月的生存期。
-
应用TIL细胞治疗晚期恶性黑色素瘤、应用TCR-T细胞治疗晚期滑膜肉瘤及恶性黑色素瘤等实体瘤也都展现出了较好的前景。
-
尤其是Rosenberg利用ACT治疗晚期恶性黑色素瘤,配合淋巴细胞删除性化疗和全身放疗预处理,获得了令人振奋的结果:完全缓解率为24%,OS时间达到38.2个月。
在术后辅助治疗领域,ACT也取得了相对较好的结果
,尤其是原发性肝细胞癌:
-
2000年,日本东京大学国家癌症研究中心人员在Lancet杂志上发表一项随机临床研究结果:中位随访4.4年时,76例肝癌患者术后辅助应用CD3AK细胞治疗,较74例对照组的复发率降低18%。
-
2015年,韩国的Lee教授在Gastroenterology杂志上公布了一项多中心、随机、开放的III期临床研究结果。114例肝癌术后或微创治疗后辅助CIK细胞治疗,较112例对照组的RFS时间延长14个月。
这些公布的研究数据提示,细胞免疫治疗作为被动免疫免疫治疗的一种方式,在部分肿瘤类型、部分患者中,不论是晚期患者还是早期患者均能显示出疗效。
本年度ESMO报道的这项日本研究中,作者从手术切除的淋巴结中扩增活化的T细胞和DC,结合化疗应用于肺癌的术后辅助治疗,取得了5年OS率提高24.3%、5年RFS率提高26.5%的结果。 相较于肺癌术后单纯辅助化疗仅能提高5年生存率5%的历史数据,这样的结果确实令人振奋。
本研究选择NSCLC术后的患者接受辅助化疗+细胞治疗,历时多年观察,终于得到阳性结果实属不易。
为何本研究能获得成功?分析原因有三方面。
-
第一,从理论上推测,免疫活性细胞治疗用于肿瘤术后辅助治疗可能更有效,因为术后残存的肿瘤细胞可能缺乏完整的肿瘤免疫抑制微环境,更容易被输入的免疫细胞杀死。
-
第二,区域引流淋巴结中往往含有较多的肿瘤细胞特异的CTL,本研究应用这些淋巴结大量扩增免疫活性细胞,这可能是本研究取得较好结果的重要原因。
-
第三,与单用化疗相比较,术后辅助免疫细胞治疗不仅能提高无复发生存率,而且能延长总生存,提示无复发生存的提高可以转换为总生存的提高;免疫细胞杀伤残留肿瘤细胞应该起到了关键作用。
当然,本研究还存在一些不足之处。
由于种种历史原因,免疫细胞治疗此前在国内应用比较混乱,表现为适应症放得过宽和管理不规范。
目前大样本的临床对照研究还十分缺乏,高级别循证医学证据不足,免疫细胞治疗肺癌在国内外各种指南或共识中尚未获得推荐。
目前,以免疫检查点抑制剂为代表的肿瘤免疫治疗发展如火如荼,免疫细胞治疗也不再沉默,仅在"ClinicalTrials"注册的CAR-T临床试验已超过200项。免疫细胞治疗因有其独特的特性应该占有一席之地,也应该有更好的未来。
然而,这需要政府出台合适的政策和严格地监管,以及从业者严谨的自律性和科学献身精神,才有望使免疫细胞治疗在国内浴火重生为广大肿瘤患者服务!













