文章来源:牛人趣事
长生生物疫苗造假事件持续发酵,后续进展牵动人心:不合格疫苗到底流向何处,补种方案如何进行,药品监管制度如何查漏补缺?今日,一篇《程序员们花14小时寻找疫苗流向》 的帖子开始在微博和各大论坛刷屏。人们在感慨程序员“技术就是战斗力”的同时,也在质疑,在互联网时代,为何政府网站公示数据仍存在不规范和不完善、电子监管迟迟无法全面推行?
早在2016年3月,山东发生5.7亿元非法疫苗大案时,人们就在质疑,疫苗追溯机制去哪了,为何电子监管码推行不下去。而在当年2月,药品电子监管码的存废之争,以民营药企状告食药监总局,食药监总局暂停推行药品电子监管码而告终……
“长生生物假疫苗”事件被疯狂刷屏前,7月6日,全国药品监管工作座谈会在京召开。国家药监局局长焦红表示,全面推进智慧监管和阳光监管。加快推进“互联网+药品监管”,全面实行审评审批电子化,加快建立药品电子通用技术文档资料管理系统,推进医疗器械注册申请电子提交信息化系统建设。
在“健康中国”战略下,药品电子化监管已经势在必行,此次假疫苗事件或成为催化剂。万物互联的智能时代,借助物联网等技术手段,能否切实提升监管水平,遏制或杜绝此次事件的再次发生?

程序员花14小时寻找疫苗流向
长生生物疫苗造假事件持续发酵,一篇《程序员们花14小时寻找疫苗流向》 的帖子在微博和各大论坛刷屏。

作者通过已经公示的信息分析出长生生物、武汉生物等生产的二类疫苗在27个省份的大致流向。

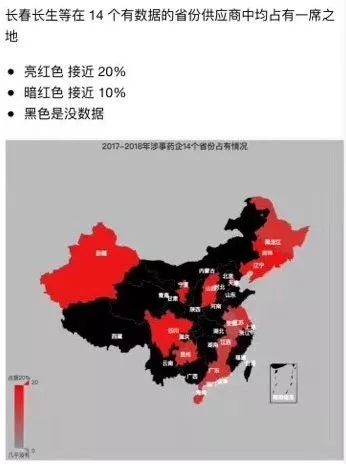
不过,作者也表示,花了整整14小时,却才整理了一半的省份。北京、上海、浙江等大省连数据都找不全,需要人工去校对。许多省份还偷偷把公示的数据强行加上了登录认证的权限。“对于一个以网络为生的我十分吃力,获取这些信息十分吃力,对于普通人而言,那就更加无从下手了。”
药品电子监管的前世今生
我国早在2006年就开始实行药品电子监管,随后,监管覆盖的范围不断扩大。
2006年
我国开始实行药品电子监管。起初仅在生产企业和特殊药品、基础药品中施行,通过在药品外包装盒上加印电子监管码来对药品生产、流通、销售全过程实施监管。通过药品电子监管码全流程覆盖,实现药品追溯信息化监管,在最小单位包装(一瓶、一针、一片)上都有监管码可以追踪。出现问题时可以第一时间追溯流向,尽快回收,最大程度减少危害。
2013年
原卫生部对2000年颁布实施的药品GSP(《药品经营质量管理规范》)进行修订,加入药品电子监管相关条款,提出“企业加印或者加贴中国药品电子监管码”“进行药品电子监管码扫码,并及时将数据上传至中国药品电子监管网系统平台”等要求。
2015年1月
食药监总局(CFDA)发布关于药品生产经营企业全面实施药品电子监管有关事宜的公告,要求2015年12月31日前,境内药品制剂生产企业、进口药品制药厂商须全部入网,2016年1月1日后生产的药品制剂应做到全部赋码,自此,中国境内所有的药品开始进入药品电子监管码系统。
2015年7月
食药监总局对原卫生部2013年修订的药品GSP再次修订,并于7月1日施行,保留了前述原有关药品电子监管相关条款。此次修订最大的变化是,将药品GSP规范的发布方由卫生部变成了国家食药监总局。
2016年1月
湖南养天和大药房企业集团有限公司以“强推药监码违法”为由起诉食药总局,其中也对这一现行制度的实际作用提出了质疑。
2016年2月
食药监总局发布公告,暂停执行药品电子监管的有关规定,同时就《药品经营质量管理规范》(修订草案)向社会公开征求意见,主要修订方向就是取消药品电子监管码。电子监管码彻底退出,未来基本方向建设药品溯源体系,以实现药品来源可查、去向可追、责任可究。
2016年4月
国务院常务会议通过《关于修改〈疫苗流通和预防接种管理条例〉的决定》。国家卫生计生委、国家食品药品监管总局会同相关部门,研究建立进一步加强疫苗流通和预防接种管理的长效机制。
但从2016年山东疫苗大案已经可以看出,电子监管码到了疾控中心和接种站等流通环节后,发挥的效果大打折扣。其中,一方面是黑色利益链作祟,另一方面是疾控信息化建设的粗放式模式使然。
中国医药企业管理协会副会长牛正乾曾表示,现阶段疫苗的安全事件已经显示,药品监管码制度并没有被真正执行,所以才会造成到目前都无法追踪到最终流向的状况。
药品电子化监管势在必行
7月6日,全国药品监管工作座谈会在京召开。国家药监局局长焦红表示,全面推进智慧监管和阳光监管。加快推进“互联网+药品监管”,全面实行审评审批电子化,加快建立药品电子通用技术文档资料管理系统,推进医疗器械注册申请电子提交信息化系统建设。
中国标准化研究院研究员刘华东表示,从当前假冒药和疫苗等问题可以看出,医药产品全链条溯源体系已经到了不得不建、不得不管的地步。
中国防伪行业协会副秘书长陈锡蓉在接受《科技日报》采访时表示,国家明确了要建立追溯制度,同时明确了企业是产品质量的责任主体,政府是执法监督检查主体。也就是说,药品生产和经营者要承担追溯体系建设的主体责任,实现“来源可查、去向可追、责任可究”。在发生质量问题时能及时召回相关产品、寻找原因。“这是建立追溯体系要达到的目的,未来建立追溯平台、架构整个标准化体系也一定要围绕这个目标进行。”
随着市场需求激增,众多企业都参与到溯源系统的开发、溯源平台的建设中来。据不完全统计,我国在溯源领域新增了上千家企业,东软、浪潮、华为等IT厂商,京东、腾讯、阿里等互联网公司,以及电信等运营商都参与其中。例如,近年来,中国电信在食品、物流、农产品溯源等方面颇多建树;阿里健康药品追溯业务先后引入法国制药巨头赛诺菲、德国默克等企业助阵。
完善我国药品追溯体系,一方面,食药监局、卫计委等各部门需要真正打破信息壁垒,实现全流通环节可追溯。另一方面,需要加强追溯技术的统一标准和规范,避免各自为阵。此外,积极利用区块链等新兴技术,实现特殊和隐私数据的隐私保护。
目前,全国多地纷纷强化疫苗等的精细化、信息化管理。例如,上海已建成市疫苗和预防接种综合管理信息系统,在全国率先实现基于信息系统覆盖全环节、全过程、可追溯综合管理。上海大力推进预防接种信息化建设,组织开发数据中心,整合和对接市民电子健康档案项目二期免疫规划信息系统、疫苗物流配送信息系统等独立系统,实现了“疫苗追溯码、疫苗产品编码、冷链设备编码、接种儿童代码、接种医生代码”的“五码合一”管理,做到每一支疫苗最小包装的全过程可追溯。
湖南省“互联网+疫苗流通与预防接种”全程信息化管理项目启动仪式近日在长沙举行。项目启动后,将在全国率先实现第二类疫苗(指由公民自费并且自愿受种的其他疫苗)从生产、储存、运输、使用到接种的全程留痕、全程可追溯,切实确保疫苗质量和接种安全。

相关延伸阅读:
2018智能音频报告:智能音箱带来的机遇















