由于在临床上对患有复发性或难治性B细胞恶性肿瘤患者具有实质性益处,嵌合抗原受体(CAR)T细胞疗法与检查点抑制一起被作为治疗肿瘤的突破性的技术。在这篇综述全面介绍了全球范围内进行的临床试验和相关参数(如靶向抗原、指征、CAR分子设计、CAR T细胞制造、抗肿瘤活性、相关毒性)的分析。目前已经有超过200个CAR T细胞临床试验,其中大多数旨在运用CD19的特异性嵌合抗原受体来治疗淋巴瘤或白血病。同样对于实体瘤的研究也在持续增长。值得注意的是,如今并不是所有正在进行的临床试验都显示出较好的结果。实际上,少数患者在接受CAR T细胞治疗后出现了一些致命性的不良反应。值得注意的是,只有不到10%的CAR T细胞临床试验正在欧洲进行。基于我们的分析,CAR T细胞临床高效发展中存在的问题既是阻碍也是机遇,尤其是在欧洲。
几十年来,癌症主要依靠外科手术、化疗和放疗来治疗。近年来,通过刺激患者的免疫应答并监测应答的持久性而建立起来的癌症免疫疗法已经成为一种新型的癌症类治疗手段。通过
T
细胞的过继性转移与基因工程表达
而获得的
嵌合抗原受体(
CAR
)T细胞能独立于MHC限制性的识别表面抗原。当靶向肿瘤表面抗原时,CAR T细胞增殖,并与抗原接触后杀死肿瘤细胞。
嵌合抗原受体(CARs )是由一个胞外结合域、一个铰链区、一个跨膜区域以及一个或多个胞内信号转导区域。第二代和第三代CARs都包含共刺激体,第四代CARs也被称作TRUCKs(卡车)或“装甲”CARs,其结合了第二代表达高抗肿瘤活性的因素,比如细胞因子、共刺激配体或可降解实体瘤胞外基质的酶。为了提高CAR T细胞疗法的安全性,既具备有自杀基因又含有合成的可控装置的智能T细胞被运用于非临床和临床研究中。
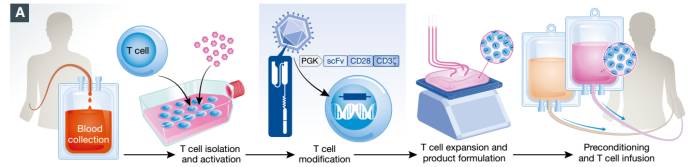
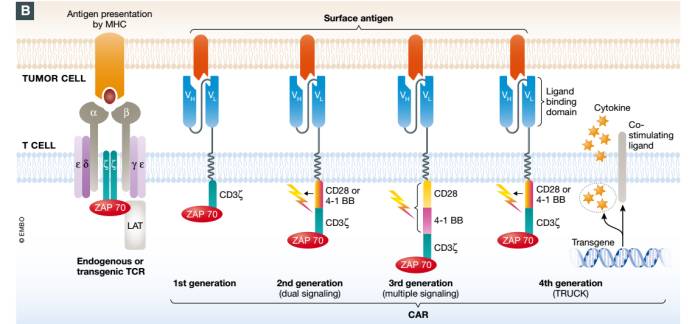
然而,
CAR T
细胞作为一种复杂的医药产品,其基础和临床前研究到临床试验的转化所带来的诸多挑战减缓了临床的发展。
通过分析
目前正在进行的和已经完成的的所有临床数据,提出了促进
CAR T
细胞产品转化的建议,特别是针对欧洲的发展。
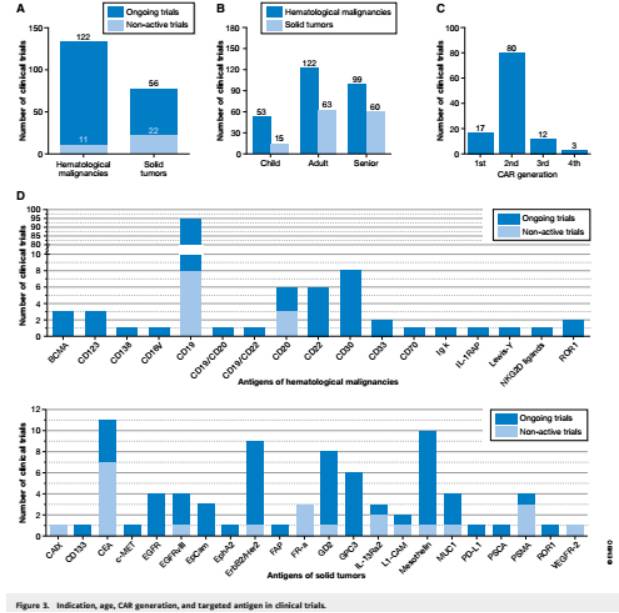
截止至2016年末,文件备案的有220例CAR T细胞试验,其中正在进行的188例中有9例处于长期随访研究阶段。大部分临床试验处于一期阶段(128例),主要是评估安全性和剂量,而1/2期和二期阶段的临床试验是评估以赶上特别是用CD19 作为CAR抗原的疗效(75例中的39例处于1/2期或2期试验)。
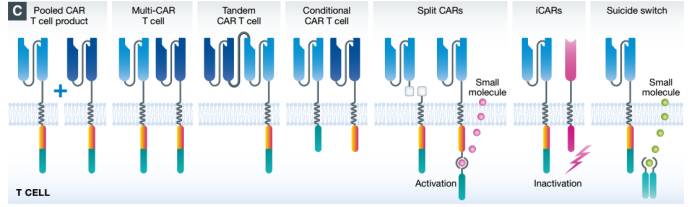
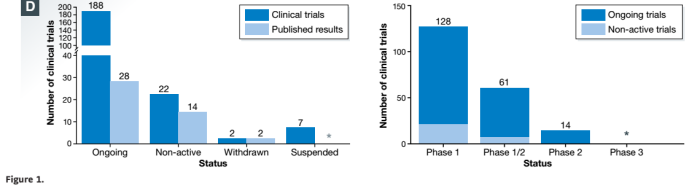
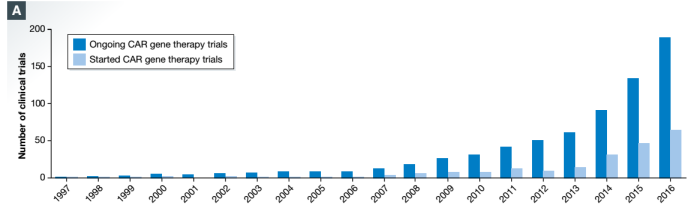

第一个
CAR T
细胞试验始于20年前的分别针对叶酸受体的晚期上皮性卵巢癌和碳酸酐酶IX(CAIX)的转移性肾细胞癌患者。CD19特异性CAR T细胞靶向B细胞恶性肿瘤
随后几年中
获得了突破性的成功。从那时起,
CAR T
细胞试验的数量大幅增加,现在呈指数增长(图2A)。仅在2016年,就有62例新加入到临床试验中。
CAR T细胞疗法始于美国,然后扩展到世界其他地方。目前,89例CAR T细胞临床试验正在美国以外的地区进行,其中最多的是中国(66例)和欧洲(14例)。欧洲的大多数试验都是在英国(8例)进行的,其次是德国(3例)和法国(3例)。
在目前的试验中,靶向血液恶性肿瘤的有
133
例,靶向实体瘤的78例。针对血液和淋巴系统的肿瘤,目前已有17种不同的CAR抗原正处于研究之中。最常见的靶点是CD19,正在进行的有56例,处于稳定的有8例。实际上更多的抗原(22例)的研究是针对实体瘤的治疗。正在进行的试验靶向有间皮素
,
ErbB2 / Her2
,
GD2(
神经母细胞瘤或肉瘤),或GPC3(肝细胞癌)。
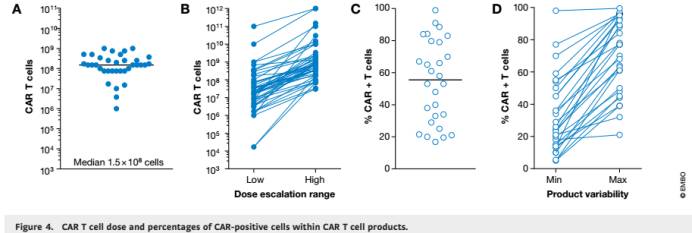
为了提高治疗耐受性和降低副作用的风险,给定的
CAR T
细胞剂量常常被分成多次注射(例如
:
每天注射
3
次)。总治疗剂量范围一般为7.5×10
7
- 3.4×10
8
CAR T
细胞(图4)。值得注意的是,细胞的注入总量取决于产品中高度可变的CAR 阳性T细胞的百分比,这种可变性不仅存在于不同的研究之间而在单个试验中也是如此。
对于B细胞恶性肿瘤,CAR T细胞疗法似乎特别有效。这是由于肿瘤细胞不仅能对CD19或CD20进行选择性和同源性表达,而且也更容易获得CAR T细胞。在CD19-CAR T细胞治疗的243例(成人199例,儿科44例)患者中,观察到超过60%有客观应答,而只有20%没有应答。值得注意的是,包括儿科和成人患者在内的试验,其临床结果均似乎与年龄无关。
在五次试验
(NCT00968760,NCT01865617,NCT01815749,NCT01626495,NCT01044069)
中,超过85%的患者达到完全反应(CR)即可认为是最佳临床结果。这些患者患有的疾病包括ALL或骨髓(BM)中可检测到的不同程度的非霍奇金淋巴瘤(NHL)
、
髓外站点或脑脊液的疾病。化疗可以减轻肿瘤在接受
CAR T
细胞治疗前的负担。在CAR T细胞治疗后,可以给获得完全应答的病人提供造血干细胞移植(HSCT),以便获得更好的治疗效果。
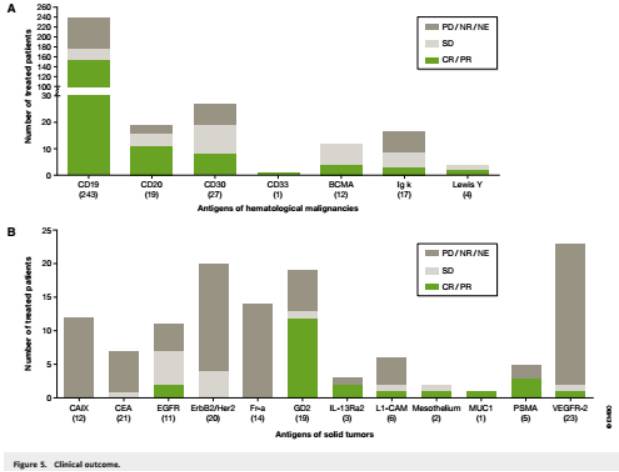
CD19-CAR T
细胞对于ALL患者是最有效的,对于NHL患者稍弱些,对于慢性淋巴细胞白血病(CLL)患者最弱,这表明了疾病类型对疗效的影响。初步看来CAR T细胞对于 NHL还是很有希望的。包括
9
例高级耐药NHL病例在内的混合患者人群中,达到完全缓解的有4例,部分缓解的2例。
与恶性血液肿瘤的结果不同的是,在实体肿瘤(12种不同抗原靶点)上,除了有证据表明单例患者有所缓解外没有发表任何令人鼓舞的数据。一个例外的情况是含有GD2的 CAR T细胞在一期临床试验中,神经母细胞瘤患者有超过50%的CR。
CD19-CAR T细胞在治疗B-ALL上有公认的高缓解率,其更优于标准化疗以及最近被批准的基于抗体的疗法,比如一种针对CD3和CD19的双特异性T细胞结合物博纳吐单抗。最近,诺华公司宣布,用于治疗患有复发性或难治性B细胞 ALL的儿童和年轻成人患者的相应CAR T细胞产品CTL019(tisagenlecleucel),得到FDA 肿瘤学药物咨询委员会的推荐。
去年的
几例死亡病例是由
Juno Therapeutics
赞助的CD19 - CAR试验中的脑水肿引起的神经毒性
所致。此外,其他多项研究中也报告了神经毒性的可逆转症状,包括意识模糊、谵妄、表达性失语症、脑病和癫痫等。神经毒性的病理生理机制仍有待阐明。
细胞因子释放综合症(CRS)CRS是最常见的药物不良反应。CRS的特点是免疫激活导致炎性细胞因子升高,尤其是il - 6。诸如高热、疲劳、恶心、心跳过速、低血压、心脏功能障碍等症状不仅在CD19 - CAR的试验中经常被报道,而且在其他的血液恶性肿瘤的抗原或者间皮素靶向治疗实体肿瘤时也有发生。目前首选的替代疗法是拖珠单抗。
Table1. 选择CD19 - CAR T细胞试验的严重副作用
|
分类
|
NCT02535364
(ROCKET)
|
NCT02348216
(ZUMA-1)
|
NCT02435849
(ELIANA)
|
NCT01865617
|
NCT01864889
|
|
赞助商
|
Juno
Therapeutics
|
Kite Pharma
|
Novartis
|
FHCRC
|
CPLA
|
|
IMP
|
JCAR015
|
KTE-C19
|
CTL019
|
N.A.
|
N.A.
|
|
CAR
型
|
CD19/CD28/CD3z
|
CD19/CD28/CD3z
|
CD19/4-1BB/CD3z
|
CD19/4-1BB/CD3z
|
CD19/4-1BB/CD3z
|
|
针对的疾病
|
ALL
|
NHL
|
ALL
|
ALL
|
ALL, NHL
|
|
拥有的病人数
|
N.A
|
51
|
50
|
29
|
9
|
|
临床结果
|
N.A
|
47% CR
|
82% CR
|
90% CR
|
55
% CR
|
|
剂量
(%CAR+
细胞
)
|
N.A
|
2×106/kg (N.A.)
|
2.9×106/kg (N.A.)
|
2×106/kg (82%)
|
≥ 3.0 × 106/kg (N.A.)
|
|
持续性
|
N.A
|
12
个月
|
≥
6
个月
|
>
8
个月
|
3
个月
|
|
条件
|
cy + flu or cy
alone
|
low-dose
cy + flu
|
cy + flu
|
cy + flu
|
随意的
|
|
死亡病例报告
|
3
例死于脑水肿
(cy + flu)
,
2
例死于脑水肿(
cy
)
|
2
例死于
CAS
|
疾病评估:
1
例死于颅内出血
|
1
例死于输入
CAR T
细胞
122
天后的不可逆神经中毒
|
1
例死于肿瘤溶解综合征,
1
例死于
GVHD
|
|
神经毒性(级别≥
3
)
|
N.A
|
接受治疗病人中的
29%
|
接受治疗病人中的
15%
|
接受治疗病人中的
34%
|
没有观察到
|
|
参考文献
|
DeFrancesco (2017),
press release
|
Neelapu et al (2016),
Locke et al (2017)
|
Grupp et al (2016)
|
Turtle et al (2016)
|
Dai et al (2015)
|
肿瘤溶解综合征
(TLS)
是由肿瘤细胞快速死亡导致的代谢紊乱(如高尿酸血症和高钾血症等)引起的。在治疗前降低肿瘤大小或通过改变注入的CAR T细胞的数量来控制肿瘤裂解程度,可以用来控制TLS。
CAR T细胞的排斥反应是由细胞和体液免疫反应导致的。为了避免这种被排斥的免疫反应,目前正在进行的临床试验中已有7个正在使用人类CAR 结构(数据集EV1和EV2)。
在CAR T细胞靶向B细胞恶性肿瘤试验中,B细胞发育不全是常见的一种不良现象。CD19和CD20抗原通过健康的和被转化的恶性B细胞表达,因此可被CD19特异性或CD20特异性的CAR T细胞杀死。B细胞发育不全可以通过注射伽玛球蛋白作为替代疗法来有效地进行控制,然而这种方法费用高昂。此外,据报道,CD20 - CAR T细胞由于CD20在正常的非B细胞组织中低水平表达,损伤病灶周围正常组织导致呼吸困难和呼吸窘迫。
据报道,在肺癌患者靶向ErbB2试验中出现了最严重的靶向毒性。由于ErbB2对正常肺细胞的识别,一名患者死于快速呼吸衰竭和多器官功能障碍。降低T细胞剂量以及使用第二代替代第三代CAR 可能会阻止这种毒性的发生。
CAR T 细胞结合了细胞疗法、基因疗法和免疫疗法的特点。在欧盟,它们被归类为高级治疗药物(ATMP)范畴内的一种基因治疗药物(GTMP)。
CAR T
细胞差异的潜在原因最近被讨论和评论。它们包括缺乏质量评判,将临床试验的创新发展成果转化为临床等方面的知识和经验以及临床试验的经费和赞助、制造设施的欠缺,对于建立小型企业只有几个例子可以借鉴经验。许多障碍制约了
CAR T
细胞技术的直接转化(表2)。其中一个最关键的问题可能是与医院提供能够生产高质量和高稳定性的CAR T细胞的大型GMP设施相关的兼容基础设施。
Table 2.
临床转化CAR
T
细胞
的障碍和可能的解决方案
|
障碍
|
可能的解决方案
|
|
有效转化的基础设施缺乏
|
支持建立包括基础研究、GMP
生产、临床研究
的临床中心
|
|
在某些欧盟成员国中,
CAR T细胞是
转基因生物
(GMOs)
,因此需要临床评价开放证书
|
通过把
CAR
T
细胞在GMO上
的特点集合成通用文件以简化程序,以后将会适用于任何CAR T
细胞产品
|














