
2017 年 11 月 17 日,清华大学生命学院施一公教授研究组就剪接体的结构与机理研究于《细胞》(Cell)杂志再次
发表
最新成果。这篇题为《酿酒酵母“催化后剪接体”的结构》(Structure of the Post-catalytic Spliceosome from Saccharomyces cerevisiae)的论文报道了酿酒酵母剪接体呈现 RNA 剪接反应完成后状态(定义为“P 复合物”)、整体分辨率为 3.6 埃的三维结构,首次展示了 pre-mRNA 中 3’剪接位点的识别状态,该结构为回答 RNA 剪接反应过程中 pre-mRNA 中的 3’剪接位点如何被识别,第二步转酯反应如何发生以及成熟的 mRNA 如何被释放等关键问题提供了重要的结构信息。

1977 年,科学家们首次发现来自于腺病毒的 mRNA 与其对应的 DNA 转录模板并不能形成连续的杂交双链,而是在杂交双链的不同位置伸出了环状的 DNA 单链。这个重大发现表明,遗传信息从 DNA 传递到 mRNA 上并不只是通过转录,还需要 pre-mRNA 剪接来进一步完成“无效”遗传信息的去除与有效遗传信息的拼接。“无效”的遗传信息不具有翻译功能,被称为内含子,而可以被核糖体翻译的有效遗传信息叫做外显子,内含子被去除、外显子被连接这一过程即为 RNA 剪接。RNA 剪接普遍存在于真核生物中,随着物种的进化,含有内含子的基因数量增加,发生 RNA 剪接的频率也相应增高,使得一个基因编码多个蛋白质成为可能,极大的丰富了蛋白质组的多样性,也是真核生物多样性的重要原因之一。
RNA 剪接是真核生物基因表达调控的重要环节之一,负责执行这一过程的是细胞核内一个巨大且高度动态变化的分子机器——剪接体(spliceosome)。从 1977 年首次发现 RNA 剪接至本世纪初,科学家们通过免疫沉淀、基因敲除、交联质谱、建立体外剪接反应系统等研究手段,初步建立起剪接体的组装与解聚的发生过程,以及蛋白与蛋白、蛋白与核酸之间的相互作用、相互调控等复杂的 RNA 剪接调控网络。RNA 剪接的本质是两步转酯反应,在剪接反应过程中,多种蛋白质 - 核酸复合物及剪接因子按照高度精确的顺序发生结合和解聚,依次形成预组装复合物 U4/U6.U5 Tri-snRNP(U4/U6.U5 三小核核糖核蛋白复合物)以及至少 7 个状态的剪接体 B、Bact、B*、C、C*、P 以及 ILS 复合物(图 1)。
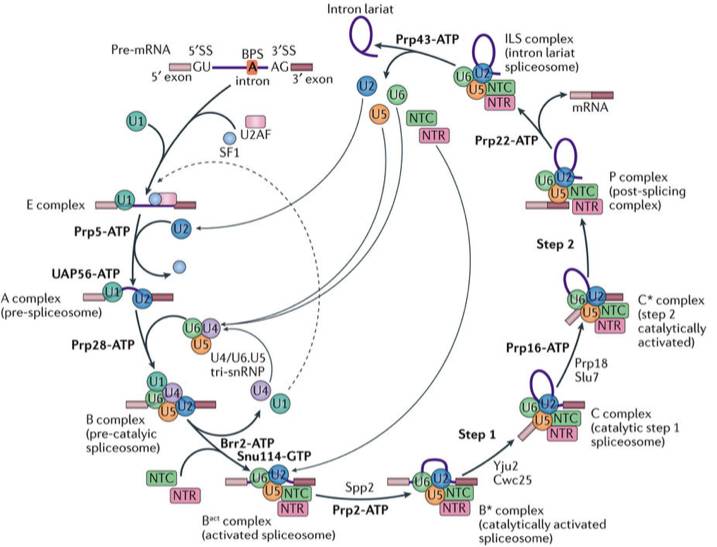
图 1 RNA 剪接示意图(图片来源: Shi Y. Nature Reviews Molecular Cell Biology, 2017.)
但是由于剪接体组成蛋白、核酸种类多,分子量大,并具有多种动态结构,该领域进展一直比较缓慢,获得剪接体的高分辨率三维结构更是世界公认的难题。2015 年,施一公研究组率先突破,在世界上首次报道了裂殖酵母剪接体 3.6 埃的高分辨率结构,首次展示了剪接体催化中心近原子分辨率的结构。这一重大研究成果对 RNA 剪接机理的研究产生革命性影响。自 2015 年第一个剪接体结构发表以后,施一公研究组相继解析了 5 个不同状态剪接体复合物的高分辨率结构,分别是酿酒酵母 3.8 埃的预组装复合物 U4/U6.U5 Tri-snRNP、3.5 埃的激活状态复合物 Bactcomplex、3.4 埃的第一步催化反应后复合物 C complex、4.0 埃的第二步催化激活状态下的 C * complex,以及 3.5 埃的内含子套索剪接体 ILS complex 的结构。这些已解析的剪接体基本覆盖了整个 RNA 剪接循环,从分子层面解释了剪接体如何组装,如何被激活,第一步转酯反应如何发生以及完成 RNA 剪接反应后的剪接体如何解聚等工作机理。但是第二步转酯反应如何被调控并发生,则需要捕获一个最为关键的剪接体状态——催化后剪接体,即 P complex。
不同于上述已解析的多个状态的剪接体,P complex 具有更高度的动态性与瞬时性,在正常生理状态下极难捕获。在最新发表的这篇《细胞》论文中,施一公研究组进一步探索并优化了蛋白提纯方案,通过在酿酒酵母中表达关键蛋白的失活突变体导致剪接体无法释放成熟的 mRNA,从而获得了稳定的、性质良好的 P complex 样品。随后利用单颗粒冷冻电镜技术重构出了总体分辨率为 3.6 埃的高分辨率冷冻电镜结构,并搭建了原子模型(图 2)。这一结构首次展示了 RNA 剪接两步转酯反应完成后剪接体的整体结构以及内部蛋白质、核酸组分的组装情况,其中可以清晰的看到原本被内含子隔开的两个外显子已经共价连接形成成熟的 mRNA 并且被 U5 snRNA 识别固定在剪接体的反应中心。值得一提的是,在这个结构中,第一次观察到了 pre-mRNA 中 3’剪接位点 AG 被分支点 A 和 5’剪接位点的第一个核苷酸 G 通过非经典的碱基互补配对共同识别的机制,这两个核苷酸 AG 还进一步被 5’剪接位点的 G 和 U6 snRNA 通过碱基堆积力固定。因此,该结构的解析,首次展示了 3’剪接位点被识别、关键蛋白 Prp22 参与成熟的 mRNA 释放等重要的结构信息,为领域内对第二步转酯反应发生时 3’剪接位点如何被识别的长达数年的猜想与争论提供了最有效的结构证据。
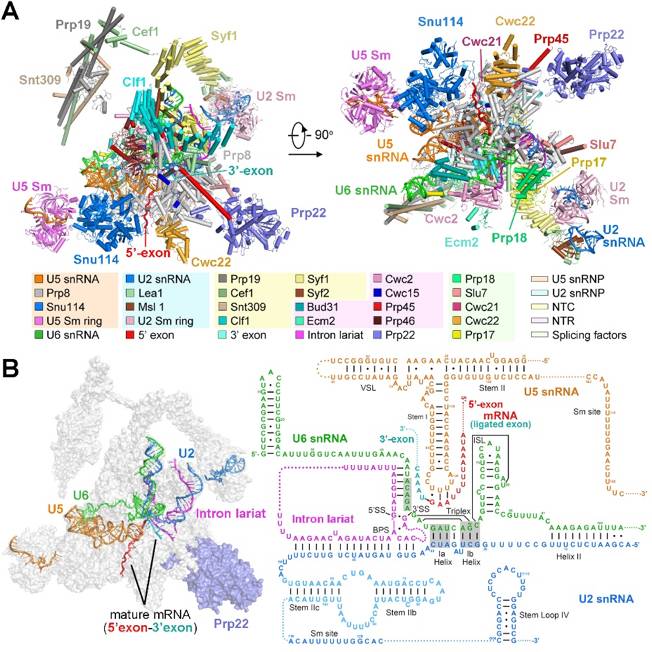
图 2 酿酒酵母催化后剪接体的三维结构
清华大学施一公研究组一直致力于捕捉 RNA 剪接过程中处于不同动态变化的剪接体结构,从而从分子层面阐释 RNA 剪接的工作机理。截至目前为止,施一公研究组在酵母中一共解析了 7 个不同状态的剪接体高分辨的三维结构(如图 3),从预组装到被激活,从发生两步转酯反应到剪接体的解聚,这 7 个状态的剪接体基本覆盖了整个剪接通路,首次将剪接体介导 RNA 剪接的过程串联起来,为理解 RNA 剪接的分子机理提供了最清晰、最全面的结构信息。由于对 RNA 剪接领域做出的重要贡献,施一公教授于不久前获得了未来科学大奖生命医学奖。














