
礼来最近也是过上了好日子。股价从1月中旬开始,一路飘红。截至今日发文,礼来股价已涨至约
878美元/股
,市值达到
8337.93亿美元
。
从消息面来看,近一个月礼来的确公布不少令投资者兴奋的喜讯。其中,最近的便是礼来公布2024年财报,
全年营收450.43亿美元,同比增长32%
(诺和诺德为25%)
,增速领先一众MNC。
除2024年的极佳的业绩表现外,让投资者心甘情愿掏出口袋里的钱的另一原因,则是礼来对2025年业绩的超绝信心。
礼来在财报中表示,
2025年其营收仍将保持32%的增长速度,预计2025年的全年营收将达到580~610亿美元。
这或将使礼来一跃进入MNC收入榜单前五,与默沙东
(2024年营收641亿美元)
、辉瑞
(2024年营收636亿美元)
和罗氏
(2024年营收约664亿美元)
同行。
财报中,礼来也对这种增长预测做出了解释,表示业绩增长主要基于替尔泊肽产品组合的产能增长和新产品/新适应症的获批。其中,就具体产品方面而言,除替尔泊肽产品组合外,礼来特别点名了
Kisunla(多奈单抗)
、Ebglyss(lebrikizumab)、Jaypirca(Pirtobrutinib)和Omvoh(mirikizumab)等。
其中,多奈单抗于2024年7月获FDA批准上市,并在首次获批后迅速准入中国及日本市场,是备受关注的AD新药之一。此次礼来的财报中并未公布多奈单抗的具体营收数据,但这里我们或许可以用其同类产品Leqembi
(仑卡奈单抗)
的数据作为参考。从卫材近日公布数据得知,
仑卡奈单抗2024前三季度共营收约 296 亿日元(约合1.94 亿美元),同比增长约2084%。
营收数据虽无法与动辄百亿起步的GLP-1类产品相比,但同比超2000%的增速却也似乎预示着这两款AD新药值得期待的未来。

渤健/卫材的仑卡奈单抗是20年来首款被FDA完全批准的AD治疗药物,被列入Science2023年度十大科学突破。
作为继Aduhelm
(阿杜那单抗)
之后全球第二款获FDA批准上市的Aβ单抗产品,其在临床试验中表现出的治疗潜力给整个Aβ单抗新药赛道打了一针强心剂。在此之前,因阿杜那单抗相关临床试验的失败,Aβ单抗治疗AD的有效性饱受争议,急需一个成功的案例进行自证。
在2023年7月获得FDA批准后,仑卡奈单抗相继获得日本、中国、韩国、英国等监管部门的批准。且就在仑卡奈单抗在中国获批上市之际,渤建宣布停止阿杜那单抗的开发,为仑卡奈单抗的开发腾出资源。至此,Aβ单抗赛道的首位勇士在众人迎接新人的鲜花和呼喊中倒下。
就在业内憧憬仑卡奈单抗上市后AD治疗的新纪元时,EMA的CHMP不建议批准仑卡奈单抗上市的消息爆出,将这款药B面的争议推到台前。
CHMP文件指出,仑卡奈单抗所展现出的疗效不足以抵消该药物的不良事件风险,即认为其临床获益小于风险,因此拒绝推荐其上市。
这里的不良事件风险,具体指受试者在临床试验中出现的
淀粉样蛋白相关影像学异常(ARIA)风险
,包括脑出血和脑水肿。礼来的多奈单抗同样存在此类风险。
多奈单抗于2024年7月获FDA批准上市,是仑卡奈单抗的潜在竞争对手。
将两款产品的基础信息进行对比,两药的共同点是作用机制类似,均基于Aβ假说研发,均适用于早期AD治疗,且均具有不容忽视的ARIA风险。另外,两药目前均在美国、日本、中国及英国获批上市
(仅列举较受关注的地区,并非产品所有获批地区)
,且因年治疗费用均较高,均被英国国家卫生与临床优化研究所
(NICE)
点名拒绝推荐使用。
值得注意的是,原本,相比于仑卡奈单抗,多奈单抗在给药频率上具有优势
(每四周给药一次)
。但根据最新消息,FDA已于2025年2月8日批准仑卡奈单抗每四周一次的静脉注射
(IV)
维持剂量给药的补充生物制品许可申请
(sBLA)
,即在完成18个月每两周一次的起始阶段治疗后,可考虑转换为每四周一次10 mg/kg的维持剂量给药方案/继续每两周一次10 mg/kg的给药方案。
两药的患者顺应性差距逐渐缩小。
另外,
仑卡奈单抗或将有望延续此前在地区准入上的先发优势,率先获得EMA批准,进入欧洲市场。
2024年11月14日,在对药品使用人群的范围进行限定
(患者有至多有一个ApoE4拷贝)
后,CHMP已经作出了建议授予仑卡奈单抗上市许可的决定。根据卫材近期更新信息,2025年2月CHMP将进一步开会讨论患者用药安全性等问题,进展积极。

ARIA风险是上述提到的两款Aβ单抗需要直面并解决的问题,目前无论是仑卡奈单抗还是多奈单抗均因同样的原因而被标注黑框警告。
据介绍,ARIA风险主要分为脑出血
(ARIA-H)
和脑水肿
(ARIA-E)
。有荟萃分析表明,ARIA通常在治疗的第六个月出现,之后会逐渐趋于稳定。关于为何会治疗中会出现ARIA风险,有人认为是由于单抗药在治疗初期,斑块中Aβ的清除速度大于血管能够运走的速度,使得Aβ在血管壁大量沉积,造成CAA相关的炎症
(ARIA-E)
等影像学表现。还有人认为,单抗药不仅去除斑块中的Aβ,同时对于小血管壁上过量沉积的Aβ也有清除作用。短时间大量清除血管壁上的Aβ后,会影响血管壁完整性,造成血液成分外渗,引起CAA-ri
(ARIA-E)
。但由于人体的修复能力在6个月后会逐渐起作用,因此出现ARIA后1-4个月,症状会逐渐趋于稳定或者消失。
在与EMA周旋过程中,卫材/渤建提供的额外分析研究结果表示,在仅携带1个或没有APOE4拷贝
(APOE是65岁以上人群发生AD的主要风险因子)
的患者中,仅有8.9%的人发生脑水肿,另有12.9%的人发生脑出血,在最初的全人群分析中这两组数据分别为12.6%和16.9%。基于这项分析结果,EMA得出结论:
对于只有1个或没有ApoE4拷贝的早期AD患者,仑卡奈单抗的益处大于风险
。这也是为什么CHMP时隔4个月,推翻此前决定,同意授予仑卡奈单抗上市许可的主要原因。
除了像仑卡奈单抗一样试图通过将药品的具体使用限定到特定人群来降低ARIA风险,获得批准外,
礼来的一项研究表明,
通过调整给药方案也可达到降低ARIA风险的目的。
2024年10月29日,礼来披露了多奈单抗的 III b期TRAILBLAZER-ALZ 6研究的积极结果,研究显示,对于早期AD成人患者,接受多奈单抗改良给药方案治疗的患者在 24 周时ARIA-E有所减少。且在淀粉样斑块和P-tau217减少方面,效果与标准给药方案相当。
其中,标准给药方案为:第0、4、8周接受700 mg多奈单抗,第四次治疗开始每四周接受1400 mg多奈单抗,至第24周;改良给药方案为:第0周接受350 mg 多奈单抗,第4周接受700 mg多奈单抗,第8周接受1050 mg多奈单抗,第四次治疗开始每四周接受1400 mg多奈单抗,至第24周。24周具体数据显示,接受改良给药方案的受试者ARIA-E发生率为14%,而接受标准给药方案的受试者ARIA-E发生率24%,相对风险降低41%。且纯合子受试者的ARIA-E风险下降更显著。
根据礼来2024财报信息,这项研究将于2025年5月完成并公布。此项研究结果或将使两款Aβ单抗的命运发生改变。
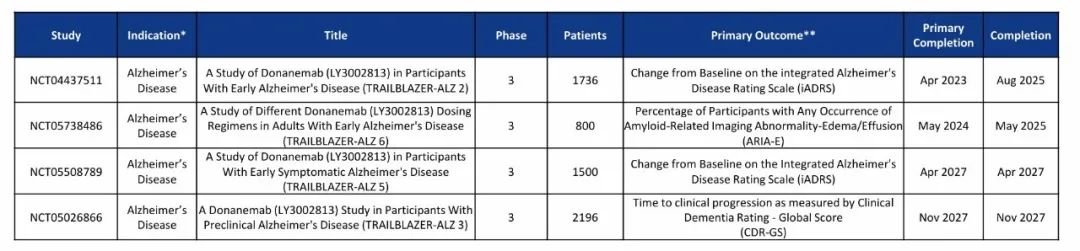
图片来源:礼来官网
小结
就在此次公布财报的同时,礼来还另公布了终止另一款AD新药——一款OGA抑制剂的临床研究的消息。
事实上,像礼来这款OGA抑制剂一样,还未闯出名堂便潦草退场的AD新药屡见不鲜。比如,罗氏的Aβ单抗Gantenerumab、Cassava Sciences 的Simufilam、Sage Therapeutics的PTI-125等。
显然,
深陷困境的AD新药研发需要更多成功案例。
而抛开产品竞争关系,两款Aβ单抗的上市对于AD新药研发都起到积极的促进作用。这主要体现在,随着新药获批上市,将促使更多医疗中心更大力度去倡导增加投资,来建设基础设施、分配更多资源,同时也会推动对患者教育。
这对于科学家研究了数百年还未确定其致病真相的AD领域来讲,至关重要。















