


摘
要:
目的
利用斑马鱼模型和中医药整合药理学平台(
TCMIP
),探究天麻抗癫痫的主要活性成分及潜在的作用机制。
方法
采用健康发育至
72 h
的
AB
系斑马鱼幼鱼为实验动物,以氨茶碱诱导形成癫痫模型,观察天麻对斑马鱼癫痫样行为的改善作用;利用
TCMIP
筛选天麻抗癫痫的靶点,构建天麻与癫痫的蛋白质相互作用(
protein-proteininteraction
,
PPI
)网络,绘制药材
-
成分
-
靶点
-
通路
-
疾病网络;利用
Autodock vina
软件对活性成分和靶点进行分子对接。
结果
天麻对氨茶碱诱导的斑马鱼的癫痫样行为发生频率具有显著改善作用(
P
<
0.05
)。通过
TCMIP v2.0
整合分析发现,天麻抗癫痫的核心靶点有
25
个,天麻素、天麻醚苷、谷甾醇、棕榈酸、西托糖苷可能是天麻抗癫痫的主要活性成分;这些活性成分可以直接作用于相应关键靶点,参与调节神经递质的平衡、维持神经元细胞正常电生理活动并影响酮体生成。
结论
天麻对癫痫样症状具有明显的改善作用,其抗癫痫的潜在机制可能与调节神经递质的平衡、神经元细胞的电生理稳态和酮体的生成有关,为天麻的临床应用提供理论依据。
癫痫是一种由多种原因引起的复杂的神经系统疾病,常伴随运动、感觉、植物神经、意识等障碍,严重危害人类的健康。随着我国人口老龄化,老年人群中癫痫发病率呈上升趋势。难治性神经系统疾病的创新药物研发进展缓慢,现有的抗癫痫药物不良反应较大,因此,寻找新型、高效、低毒的抗癫痫药物仍然是临床迫切需要解决的问题
[1]
。
天麻为兰科植物天麻
Gastrodiaelata
Bl.
的干燥块茎,主产于湖北、四川、陕西等地
[2]
。《本草纲目》中记载天麻
“
眼黑头旋,风虚内作,非天麻不能治。天麻乃定风草,故为治风之神药
”
。研究发现,天麻对神经细胞损伤具有显著的保护作用,具有抗惊厥、防止癫痫大发作、镇静催眠、镇痛等作用
[3-4]
。中医临床治疗癫痫的处方中,其核心药味均有天麻
[5]
。但天麻抗癫痫的具体物质基础和作用机制仍有待深入挖掘。
目前用于癫痫疾病研究的模型主要为大鼠和小鼠模型,在大规模药物筛选方面具有局限性且成本较高。斑马鱼作为一种新兴的模式动物,基因组与人类同源性达到
87%
。研究发现,斑马鱼中可观察到啮齿动物类似的癫痫表型,且斑马鱼产卵量高、实验周期短、成本低,可以实现高通量筛选
[6-8]
。中医药整合药理学研究平台(
TCMIP
)作为一个专业的网络药理学工具,整合了中医药百科全书(
ETCM
)等优质的数据库资源,通过人工智能、网络可视化等先进的方法形成了其独特的优势,可以为研究天麻抗癫痫的潜在作用机制提供强大的数据支撑和计算辅助
[9]
。本研究采用模式动物斑马鱼观察天麻对癫痫发作的保护作用,并利用
TCMIP
平台分析其潜在机制。
1.1
动物
AB
型斑马鱼,由山东省科学院药物筛选技术重点实验室提供,饲养于斑马鱼养殖系统,温度设定为
28
℃,
pH 6.8
~
7.5
,
14 h
光照
/10 h
黑暗,用丰年虫早晚饲喂
2
次。实验所用幼鱼均由健康雌雄鱼以
2∶1
比例自然交配而得。
1.2
药品与试剂
天麻(批号
20191103
)购自安徽六安,由山东第一医科大学(山东省医学科学院)药学与制药科学学院韩利文副研究员鉴定为兰科植物天麻
G. elata
Bl.
的干燥块茎;氨茶碱(质量分数为
98%
)、丙戊酸钠(质量分数为
98%
)购自阿拉丁试剂公司;天麻素(批号
B21243
,质量分数≥
98%
)购自源叶生物;乙腈为色谱纯,其余试剂为分析纯。
1.3
仪器
斑马鱼养殖系统(北京爱生公司);
LC-30A
液相
色谱系统、
Shim-pack GIST C
18
色谱柱(
100 mm
×
3.0 mm
,
2 μm
)(日本岛津公司);
SZX-16
型体视荧光显微镜(日本
Olympus
公司);
SPX-300B-G
型博讯光照培养箱(上海基星生物科技有限公司)。
2.1
天麻提取物的制备及含量测定
天麻用粉碎机粉碎,过
60
目筛,称取
10 g
天麻粉末,置于
500 mL
圆底烧瓶中,加入
100 mL 80%
乙醇,加热回流提取
2
次,每次
1 h
,合并提取液,减压浓缩,真空干燥,得到天麻提取物,于
4
℃保存,临用前用蒸馏水稀释至所需浓度。
按照《中国药典》
2020
年版方法进行测定,以乙腈
-0.05%
磷酸水溶液梯度洗脱,检测波长
220 nm
,以天麻素为对照品,外标一点法计算,天麻提取物中天麻素的质量分数为
1.24%
。
2.2
药液的配制
精密称定氨茶碱,溶于蒸馏水,配制成质量浓度为
10 mg/mL
的溶液;精密称定丙戊酸钠,溶于蒸馏水,配制成质量浓度为
100 mg/mL
的溶液。于
4
℃保存备用,临用前用蒸馏水稀释至所需浓度。
2.3
斑马鱼实验
将正常孵化的受精后
72 h
(
hours post- fertilization
,
hpf
)斑马鱼幼鱼转移至
6
孔板中,设置模型组、丙戊酸钠(
0.25 mg/mL
)组和天麻提取物(
0.1
、
1.0
、
10.0 mg/mL
)组,每组
10
条。各给药组加入相应药物预处理
24 h
后,各组再加入氨茶碱(
2 mg/mL
)造模
4 h
,观察斑马鱼幼鱼活动情况,记录斑马鱼抽搐频率(
1 min
内发生抽搐的次数)。
2.4
天麻活性成分和癫痫相关靶点的获取
以
“
天麻
”
为关键词,在
TCMIP v2.0
药材数据库功能模块中检索获得天麻的活性成分及靶点;以
“
癫痫”“
癫痫痉挛
”“
癫痫性发作”“癫痫持续状态”
为关键词在疾病相关分子库模块进行检索,获取癫痫相关的靶点。
2.5
天麻与癫痫靶点蛋白质相互作用
(
protein- protein interaction
,
PPI
)
网络的构建及核心靶点的筛选
通过
TCMIP v2.0
的中医药关联网络挖掘功能模块构建天麻与癫痫靶点的
PPI
网络。计算网络拓扑值,以度值、节点紧密度、节点介度的
2
倍中位数卡值,获得核心节点。将筛选到的天麻与癫痫的共同靶点作为核心靶点。度值越高,相应核心节点的重要性越高。
2.6
核心靶点
基因本体
(
gene ontology
,
GO
)
功能和
京都基因与基因组百科全书
(
Kyoto encyclopedia of genes andgenomes
,
KEGG
)
通路富集分析
将“
2.5
”项下得到的核心靶点分别导入
DAVID
(
https://david.ncifcrf.gov/
)和
Reactome
(
https://reactome.org/
)进行
GO
功能和
KEGG
通路富集分析。
2.7
药材
-
成分
-
核心靶点
-
通路
-
疾病网络的构建
在中药网络调控机制挖掘结果界面中自定义关联网络可视化功能区,绘制网络图,将“
2.5
”项下补充的天麻与癫痫的共同靶点添加到网络图中。
2.8
天麻活性成分与抗癫痫相关靶点的分子对接
将天麻活性成分和抗癫痫相关靶点进行分子对接,运用
PubChem
(
https://pubchem.ncbi.nlm.nih. gov/
)找到活性成分的
3D
结构,进行能量最低处理。将从
Uniprot
(
https://www.uniprot.org/
)中得到的蛋白名称输入
RCSB PDB
(
https://www.rcsb.org/
)中,得到关联的蛋白质,进行纯净、加氢、加电荷等处理,运用
AutodockVina
[10]
进行分子对接。
2.9
数据分析
数据以
表示,两组数据比较使用
SPSS 18.0
软件进行方差分析(
ANOVA
)。
3.1
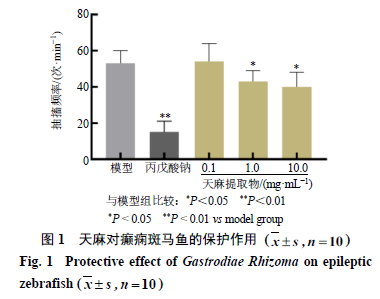
天麻对癫痫斑马鱼的保护作用
氨茶碱可刺激内源性肾上腺素和去甲肾上腺素的释放,可引起斑马鱼运动失调、抽搐引起的背部扭曲等癫痫症状,常用于制备斑马鱼癫痫模型
[11]
,而
加入丙戊酸钠后,斑马鱼癫痫样症状明显减轻
[12]
。如图
1
所示,
1.0
、
10.0mg/mL
天麻提取物能够显著
抑制斑马鱼幼鱼的癫痫样抽搐(
P
<
0.05
),呈剂量相关性,表明天麻对斑马鱼的癫痫样发作具有一定的保护作用。
3.2
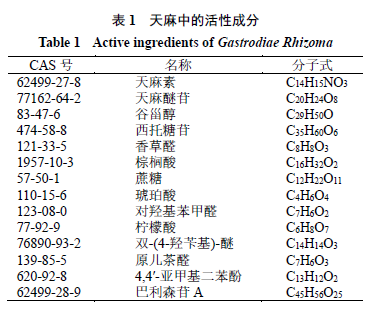
天麻活性成分及癫痫相关靶点的获取
如表
1
所示,共收集到天麻的
21
个活性成分,分别为天麻素、天麻醚苷、谷甾醇、香草醛、琥珀酸、西托糖苷等,其中
7
个活性成分未检索到候选靶点,故未列出;共有
233
个候选靶点。通过疾病相关分子库共获得癫痫疾病描述的相关靶点共
97
个,其中
“
癫痫”
20
个、
“
癫痫性发作”
1
个、
“
癫痫痉挛
”
7
个、
“
癫痫持续状态”
69
个。
3.3
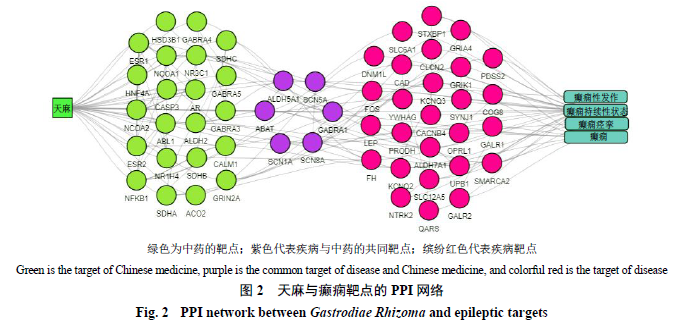
天麻与癫痫靶点
PPI
网络的构建
如图
2
所示,天麻与癫痫靶点的
PPI
网络有
55
个节点,度值越高,其在网络中的作用越高。度值排名前
10
的节点分别为核受体辅激活因子
1
(
nuclear receptor coactivator 1
,
NCOA1
)、雌激素受体
1
(
estrogen receptor 1
,
ESR1
)、糖皮质激素受体(
nuclear receptor subfamily 3 group Cmember 1
,
NR3C1
)、核转录因子
-κB
(
nuclear factor-kappa B
,
NFKB1
)、核受体辅激活因子
2
(
nuclear receptor coactivator 2
,
NCOA2
)、钙调蛋白
1
(
calmodulin 1
,
CALM1
)、雌激素受体(
androgen receptor
,
AR
)、雌激素受体
2
(
estrogen receptor 2
,
ESR2
)、
N
-
甲基
-
D
-
天冬氨酸受体
2A
(
N
-methyl-
D
-aspartate receptor 2A subunit
,
GRIN2A
)、电压门控钠通道
-8α
亚型(
mus musculus voltage-gated sodiumchannel type 8α
,
SCN8A
)。此外,还有
5
个节点为天麻与癫痫的共同靶点,分别为
γ-
氨基丁酸
A
受体(
γ-aminobutyric acid
,
GABRA1
)、
4-
氨基丁酸转氨酶(
4-aminobutyrate aminotransferase
,
ABAT
)、醛脱氢酶
5
家族
A1
(
aldehyde dehydrogenase 5 family, member A1
,
ALDH5A1
)、电压门控钠通道
-1α
亚型(
mus musculus voltage-gated sodiumchannel type 1α
,
SCN1A
),提示这些靶点为天麻抗癫痫的关键靶点。
3.4
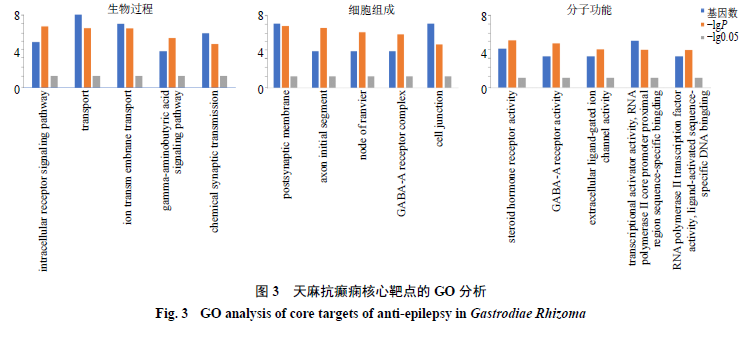
核心靶点
GO
和
KEGG
富集分析
将核心靶点导入
DAVID
进行
GO
分析,得到
P
<
0.05
的生物学功能条目共
72
条,其中生物过程(
biological process
,
BP
)、细胞组分(
cell component
,
CC
)和分子功能(
molecular function
,
MF
)各
39
、
13
、
19
条,按照重要性选择前
5
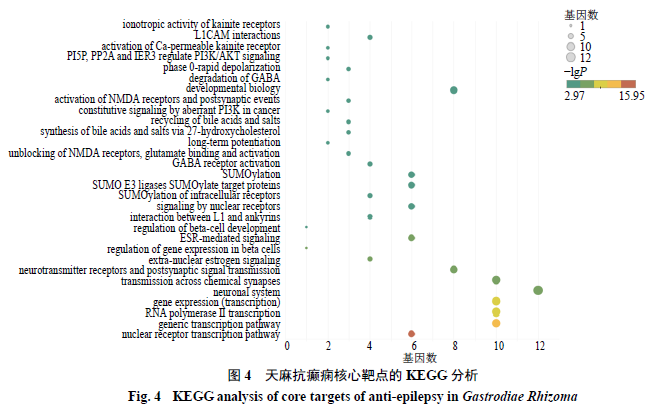
条分别进行可视化分析,如图
3
所示。将核心靶点导入
Reactome Pathway
进行
KEGG
分析,共得到
105
条通路,将前
30
条进行可视化操作,如图
4
所示,涉及核受体转录过程(
nuclear receptor transcription pathway
)、基因转录途径(
generic transcription pathway
)、化学突触传递(
transmission across chemical synapses
)、
β
细胞发育的调控(
regulation of β-cell development
)、
L1
和锚蛋白类的相互作用(
interaction between L1 and ankyrins
)、细胞内受体的泛素化修饰(
SUMOylationof intracellular
receptors
)、
γ-
氨基丁酸受体的激活(
GABAreceptor activation
)、门冬氨酸受体的释放及谷氨酸的结合与活化(
unblockingof NMDA receptors
,
glutamate binding and activation
)、
27-
羟基胆固醇合成胆汁酸和胆盐(
synthesisof bile acids and bile salts via 27-hydroxycholesterol
)等通路。
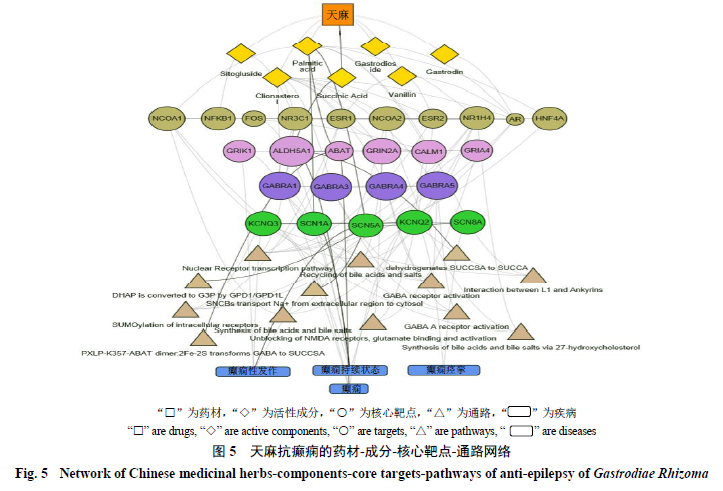
3.5
药材
-
成分
-
核心靶点
-
通路
-
疾病网络的构建
如图
5
所示,天麻的
7
种成分(天麻醚苷、天麻、谷甾醇、香草醛、棕榈酸、西托糖苷、琥珀酸)主要通过作用于
NCOA1
、
NR3C1
、
ESR1
、
GABRA1
等靶点以及胆汁酸、胆汁酸盐的合成和循环、
γ-
氨基丁酸受体的激活、门冬氨酸受体的释放、细胞内
受体的泛素化修饰、核受体传导、琥珀酸半醛脱氢等通路,从而发挥抗癫痫作用。
3.6
分子对接结果
在
PubChem
中寻找
“
药材
-
成分
-
核心靶点
-
通路
”
网络中
活性成分对应的小分子,与核心靶点进行分子对接,小分子与靶点蛋白的结合能越低,越可能发挥更大的作用。如表
2
所示,谷甾醇与电压门控钾离子通道
KCNQ2
及
NCOA1
、棕榈酸与
CALM1
、西托糖苷与














