
人类表皮生长因子受体(
HER
)家族的成员,包括HER1(
EGFR
)、HER2、HER3和HER4,在调节细胞增殖、存活、分化和迁移方面发挥了核心作用。EGFR家族的过表达被认为是和多种肿瘤类型相关的最常见的细胞失调之一。
抗体偶联药物(ADC)是一类新的、有前途的抗癌治疗药物,它将抗体的癌症特异性与化疗药物的细胞毒性结合起来。美国食品和药物管理局(
FDA
)分别于2013年和2019年批准了两种HER2导向的ADC,即trastuzumane-emtansine(
T-DM1
)和trastuzumab-deruxtecan(
DS-8201a
),用于治疗HER2阳性转移性乳腺癌。
2021,中国国家医药产品管理局(
NMPA
)批准了第三种HER2导向的ADC,即disitamab vedotin(
RC48
),用于局部晚期或转移性胃或胃食管交界癌。目前,有多个针对HER家族受体(
EGFR、HER2或HER3
)的ADC正在进行临床试验。这些药物的成功改变了HER阳性癌症的治疗,并为ADC发展领域注入了新的活力。
由于HER家族在致癌过程中的关键作用,在过去二十年中开发了两种主要的靶向疗法来阻断HER驱动的通路,其中包括抑制细胞内结构域酪氨酸激酶活性的小分子化合物,以及针对受体细胞外结构域(
ECD
)的单克隆抗体。
八种酪氨酸激酶抑制剂(
TKIs
)已被批准用于临床,它们与HER家族的激酶结构域紧密结合。HER家族的第一代TKI包括厄洛替尼、吉非替尼和拉帕替尼。厄洛替尼和吉非替尼选择性结合EGFR的ATP结合位点,是迄今为止仅有的两种单一靶点TKI,而拉帕替尼是第一种被批准用于乳腺癌的TKI,对EGFR和HER2表现出同等的活性。下一代TKI包括阿法替尼、达科替尼和奈拉替尼是不可逆的pan-HER2抑制剂(
EGFR、HER2和HER4
),阿法替尼和达科替尼被批准用于非小细胞肺癌(
NSCLC
),而奈拉替尼被批准用于乳腺癌。在上述六种TKI中,厄洛替尼、吉非替尼和阿法替尼目前仍是非小细胞肺癌的一线治疗药物。最后,奥西米替尼是第三代EGFR TKI,对具有EGFR激活突变和EGFR T790M突变的NSCLC患者具有显著疗效。
与TKIs不同,单克隆抗体与受体的细胞外结构域结合,从而阻止受体与配体结合或其二聚化。迄今为止,多个针对HER受体的单克隆抗体已被批准用于临床。目前市场上有两种HER2靶向单抗,包括曲妥珠单抗(
Herceptin®
)和帕妥珠单抗(
Perjeta®
)。曲妥珠单抗于1998年首次获得批准,已广泛用于治疗HER2阳性乳腺癌和胃癌,而帕妥珠单抗于2012年获得批准,自2012年以来一直用于治疗HER2阳性乳腺癌。
用曲妥珠单抗和帕妥珠单抗双重阻断HER2已成为转移性乳腺癌患者的一线治疗方法。迄今为止,已有五种EGFR靶向单克隆抗体被批准用于临床,即cetuximab(
Erbitux®
)、panitumumab(
Vectibix®
)、nimotuzumab(
BIOMAB-EGFR®
)、necitumumab(
Portrazza®
)和amivantamab(
Rybrevant®
)。Cetuximab和panitumumab均被批准用于转移性结直肠癌(
CRC
),而cetuximab也被批准用于治疗KARS野生型CRC和晚期鳞状细胞癌。Nimotuzumab被批准用于治疗头颈部鳞状细胞癌,Necitumumab被批准用于治疗难治性转移性鳞状非小细胞肺癌。与上述抗EGFR单抗不同,amivantamab是一种双特异性抗体,可同时结合EGFR和MET的细胞外结构域,最近已被批准用于治疗具有EGFR外显子20插入突变的晚期或转移性NSCLC成年患者。
EGFR在多种肿瘤类型中扩增或过表达,已被证实为重要的肿瘤靶点。然而,目前还没有靶向EGFR的ADC被批准用于癌症的治疗。目前,有三种针对EGFR的ADC正在进行临床研究,包括depatuxizumabmafodotin(
ABT-414
)、MRG003和M1231。ABT-414是迄今为止最领先的EGFR靶向ADC,已进入III期临床试验。
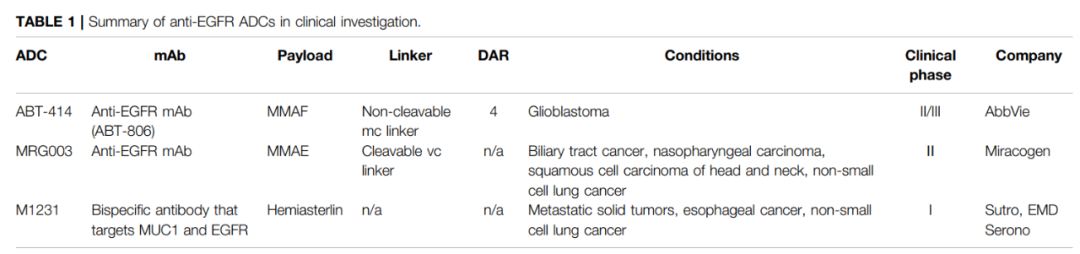
Depatuxizumab-Mafodotin(ABT-414)
ABT-414由一种EGFR特异性人源化抗体(
ABT-806
)、一种不可切割的马来酰亚胺己基(
mc
)连接子和一甲基金司他丁F(
MMAF
)组成,与每个单克隆抗体结合的MMAF的平均数量约为4个。ABT-806与EGFR富含半胱氨酸的结构域(
CR1
)中的一个隐蔽表位结合,与其他EGFR靶向抗体相比,ABT-806在正常组织中与EGFR的结合活性最低,ABT-414保留了ABT-806的优良结合和功能特性。
在一项I期临床试验(
NCT01800695
)中,探索了ABT-414作为单一疗法或与替莫唑胺联合治疗胶质母细胞瘤患者的安全性、药代动力学和抗肿瘤疗效。ABT-414在I期试验中证明了可管理的安全性和可接受的药代动力学特征。然而,在二期临床研究(
NCT02343406
)中未达到总生存率的主要终点。目前,一项II/III期研究(
NCT02573324
)正在对新诊断的具有EGFR扩增的胶质母细胞瘤的参与者进行研究。然而,由于缺乏生存益处,该试验自2019年终止。
MRG003
MRG003由一种全人源EGFR特异性IgG1抗体、一种蛋白酶可切割缬氨酸瓜氨酸(
vc
)连接子和一甲基auristatin E(
MMAE
)组成。MRG003已经进行了I期临床试验(
CTR20180310,NCT04868344
),以评估MRG003作为单一药物治疗复发或难治性实体瘤患者的安全性、药代动力学和疗效。令人鼓舞的是,MRG003显示出可接受的安全性和潜在的抗肿瘤活性。目前,针对复发或转移性鼻咽癌、头颈部鳞状细胞癌、晚期转移性胆道癌和晚期非小细胞肺癌患者的MRG003(
NCT05126719、NCT04868162、NCT04838964和NCT04838548
)的多项II期研究正在进行中。
M1231
M1231是一种探索性ADC,半星霉素相关有效载荷与同时针对MUC1和EGFR的双特异性抗体结合。半星霉素是一种三肽,通过与微管蛋白结合发挥其细胞毒性,从而破坏正常的微管动力学。M1231的详细结构信息和临床前数据尚未公布。目前正在进行I期临床研究(
NCT04695847
),作为转移性实体瘤、食管癌和NSCLC患者的单一疗法。
HER2是HER家族癌症治疗的另一个重要靶标。到目前为止,市场上已经有三种HER2靶向ADC,
T-DM1
(
Kadcyla
)是第一个被FDA批准用于治疗晚期HER2+乳腺癌的Her2靶向ADC药物,同时也被批准用于新辅助治疗后残存病灶的早期高危患者。2019年,
T-DXd
(
DS-8201;ENHERTU
) 成为第二个获批的新型Her2靶向ADC药物,它在治疗难治性Her2+转移性乳腺癌患者中显示出显著的抗肿瘤活性。另外,2021年荣昌生物的
RC48
在中国获准上市,用于治疗至少接受过2种系统化疗的Her2过表达局部晚期或转移性胃癌患者。

目前,许多下一代HER2靶向ADC目前正在临床试验中进行研究。这些新型药物采用不同的有效载荷和连接技术进行设计,以进一步提高其疗效和耐受性。
这些研究展现了治疗HER2阳性实体瘤患者的未来发展方向。

此外,有七个Her2靶向的ADC被宣布终止临床试验。

这些数据显示,靶向Her2的 ADC的临床失败率相对较低(
23.3%
),表明Her2是ADC非常理想的靶点。
Trastuzumab duocarmazine
Trastuzumab duocarmazine(
SYD985
)是一种HER2靶向 ADC,由曲妥珠单抗的主体与可切割连接子以及杜卡霉素有效载荷偶联而成。有效载荷是膜可渗透的,因此无论HER2表达如何,都有可能进入邻近细胞。该ADC的1期研究显示,在HER2阳性和HER2低表达乳腺癌中具有可接受的毒性和抗肿瘤活性。在这项针对HER2阳性MBC患者的扩展研究中,33%的患者(
16/48
)获得了客观响应。
这些结果构成了III期TULIP试验(
NCT03262935
)的基础,纳入了经T-DM1治疗的HER2阳性MBC患者,主要终点为评估PFS,结果尚未报告。SYD985目前也正在与紫杉醇(
NCT04602117
)和niraparib(
NCT04235101
)联合进行研究。SYD985与阿霉素和环磷酰胺的联合应用也正在I-SPY试验(
NCT01042379
)中进行研究,这是一项大型适应性新辅助试验,旨在评估不同生物制剂联合化疗的病理完全应答(
pCR
)率。
A166
A166由曲妥珠单抗与duostatin-5(
一种auristatin衍生物
)偶联而成。2020年,对27名可评估患者进行的I期试验(
NCT03602079
)结果显示DCR为59%,在3.6mg/kg和4.8mg/kg的剂量水平下,7名患者(
26%
)观察到PR。该研究正在进行中。
XMT-1522
XMT-1522是由HT-19抗体骨架构成的ADC,HT-19是一种人IgG1抗HER2单克隆抗体,与HER2的结构域IV结合,形成一个不同于曲妥珠单抗结合位点的表位,有效载荷为auristatin衍生物(
AF-HPA
)。临床前数据显示XMT-1522对HER2阳性的BC和胃癌细胞系以及对T-DM1耐药的异种移植模型有效。一项I期研究(
NCT02952729
)的初步结果显示,在剂量为16和21.3mg/m2组中,总体DCR为83%(
5/6
),有1例 PR,在剂量低于16 mg/m2的患者中,DCR为25%(
3/12
)。
ALT-P7(HM2/MMAE)
ALT-P7是一种新型的HER2靶向ADC,由曲妥珠单抗变体与MMAE偶联而成。首次人体研究的结果显示,在可测量的患者中,DCR为77.3%(
17/22
),有2例PR。在经过中位既往治疗为6的患者中,中位PFS为6.2个月,目前,第二阶段的研究正在计划中。
ARX788
ARX788是一种位点特异性ADC,由抗HER2抗体与一种高效微管蛋白抑制剂AS269偶联而成,使用一种独特的非天然氨基酸偶联技术和不可切割的连接子。第一阶段试验的结果显示在HER2阳性BC中具有抗肿瘤活性,在48名可评估患者中,1.3mg/kg剂量组的ORR为56%,剂量为1.5mg/kg时ORR提高到63%。因此FDA于2021年1月授予了快速通道认定。目前ARX788正在对HER2阳性实体瘤患者进行一项两部分的1期剂量递增试验(
NCT03255070
)。
PF-06804103
PF-06804103由曲妥珠单抗衍生抗体通过可切割连接子与AUR-06380101(
一种新型有效的auristatin衍生物
)偶联而成。PF-06804103在低HER2表达的乳腺、胃和肺肿瘤模型中显示出有效性。剂量递增1期研究(
NCT03284723
)的初步结果显示,在≥3.mg/kg的剂量下,ORR为52.4%(
11/21
)。所有患者均曾接受过HER2靶向治疗,既往治疗中位数为6。
MRG002和ZW49
MRG002和ZW49是两种
ADC,它们都使用auristatin作为有效载荷与不同的HER2单克隆抗体偶联,前者使用人源化抗HER2 IgG1单克隆抗体,后者使用ZW25,一种分别识别trastuzumab和pertuzumab结合位点的抗HER2双特异性抗体。目前两种ADC正在进行第一阶段临床试验(
CTR20181778、NCT04492488、NCT04742153、NCT03821233
)。
BDC-1001
BDC-1001由曲妥珠单
抗的生物类似物与TLR 7/8激动剂通过不可切割的连接子偶联而成。BDC-1001能够激活抗原呈递细胞,同时保留抗体介导的效应器功能,如ADCC。临床前数据显示BDC-1001在异种移植模型中诱导有效的免疫介导的抗肿瘤作用,并且首次在人类研究中证明了其安全性。BDC-1001单独或与抗PD1联合使用的疗效结果仍在等待中(
NCT04278144
)。
最后,一种新型设计的基于pertuzumab的ADC在酸性内体pH下对HER2亲和力变低,这样的设计在HER2低表达异种移植模型中显示出溶酶体输送和细胞毒性增加,预计将进入进一步的临床试验。
HER3在多种癌症类型中过表达,并被认为可预测不良预后。尽管缺乏显著的激酶活性,但HER3通过HER3同源二聚化或HER2/HER3异源二聚化发挥其功能,从而激活下行信号通路以促进细胞存活和增殖。重要的是,HER3信号已被证明与抗EGFR/HER2疗法的耐药机制有关,并且正在成为EGFR突变NSCLC的一个有希望的治疗靶点。
Patritumab deruxteca
n(
U3-1402
)是目前唯一一个正在进行临床研究的ADC。
U3-1402由抗HER3单克隆抗体(
Patritumab
)、可切割的GGFG连接体和拓扑异构酶I抑制剂Dxd组成。U3-1402的DAR为8,U3-1402在其他人类HER家族受体(
包括EGFR、HER2和HER4
)中显示出较高的HER3特异性结合亲和力,并且在患者来源的异种移植模型中也显示出强大的抗肿瘤活性,具有可接受的安全性。目前,针对HER3阳性转移性乳腺癌的U3-1402 I/II期研究(
NCT02980341
)正在进行中。该试验的早期报告表明,U3-1402具有良好的抗肿瘤活性,且具有可耐受的安全性。同时,U3-1402正在进行一项I期临床研究(
NCT03260491
),以探索在转移性或不可切除的非小细胞肺癌中的疗效和安全性。














