反应的特异性依赖于在特定刺激下被激活的分子成分和信号通路。
鉴于大量的免疫激活刺激,但信号因子的数量有限,出现了两个原则,有助于解释分子网络的刺激特异性调控:
信号通路的
组合
和
动态控制
。这些原理解释了免疫反应基因的刺激特异性激活依赖于(a)不同的刺激激活不同的信号调节因子组合,而(b)不同的刺激激活相同的调节因子,但具有不同的动态活动模式。
特定的反应是根据细胞如何感知配体而启动的。人类巨噬细胞通过10个toll样受体(TLRs)感知配体,并检测细胞外和内体环境,22个胞质nod样受体(NLRs),3个RIG-I样受体(RLRs)和DNA传感器环GMP-AMP合酶(cGAS)。
免疫激活细胞因子,如干扰素、IL-1、TNF和其他TNF超家族成员,可被它们在质膜上的同源受体所感知。为了引起刺激特异性反应,配体-受体的相互作用必须基于分子特异性。事实上,即使是低复杂度的PAMP也可以由不同的TLR家族成员来区分,这种特异性的生物物理基础已经被研究过。然而,配体的功能识别也可能涉及其他机制,如定位或动力学校对。
尽管病原体传感器的数量非常惊人,但病原体和潜在的PAMPs和DAMPs的数量甚至更多。
许多受体介导对不同配体的感知
。
例如,TLR4,已知的内毒素[脂多糖(LPS)]传感器,也介导对DAMPs的感知,如HMGB1、血清淀粉样蛋白A(SAA)和MRP8/MRP14。相互作用的范围可以通过可溶性或膜结合的辅助因子,如CD14来扩大。然而,两个配体被相同的受体识别并不一定意味着它们产生相同的反应。配体-受体的相互作用受信号适配器招募、受体内化和配体降解的特定动力学的控制,这不仅可能产生刺激特异性的信号振幅,还可能产生刺激特异性的信号动力学。这种动态编码机制也允许细胞通过相同的受体对相同的刺激产生剂量特异性的反应。
类似的考虑也决定了受体如何激活下游信号通路,这些信号通路是由少量的初级信号适配器介导的:MyD88、TRIF、TRAF2/6、MAVS、STING和ASC。
除TLR3外,所有的TLR都利用MyD88,以及IL-1受体
。
TRIF与TLR3和TLR4相连
。TRAFs由TNFR家族成员参与,ASC由NLR参与,由cGA参与。
然而,
特异性
是可能的,因为适配器招募和信号通路激活的相对强度和动态可能有所不同。
例如,在对LPS的反应中,TLR4在质膜上二聚并启动适配器MyD88的寡聚,或者它可以通过核内体内化成为信号,在那里它与不同的适配器TRIF相互作用,启动TRIF依赖的信号传导。
适配器和相关的泛素链
最终激活一组有限的激酶-转录因子模块
。虽然干扰素在没有专用信号适配器的情况下激活JAK-STAT通路,但四种主要的免疫反应信号通路可以映射到这些适配器上:IRF3被TRIF、MAVS和刺痛适配器激活;MAPKp38被MyD88强烈激活;但NF-κB和JNK/ERK通路被所有适配器激活(ASC通过IL-1β反馈回路)。
因此,如果反应特异性仅依赖于组合编码,则只观察到四种模式:NF-κB和JNK/ERK(例如,对TNF的反应);NF-κB、JNK/ERK和IRF3[例如,对聚(I:C)的反应];NF-κB、JNK/ERK和MAPKp38(例如,对Pam3CSK4的反应);以及NF-κB、JNK/ERK、MAPKp38和IRF3(例如,对LPS的反应)。然而,对这些通路的刺激特异性动态控制可能允许额外的特异性。
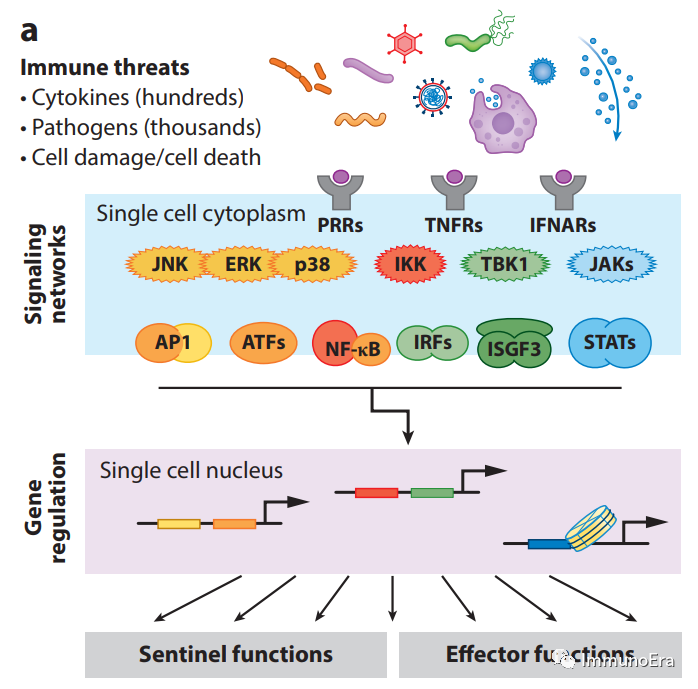
鉴于反应特异性不仅是蛋白质结构中基因编码的生物物理相互作用特异性的功能,而且是信号
幅度和时间的动态
,它受信号转导器表达水平和定位差异的影响。

特异性研究方法(Annu. Rev. Immunol. 2022. 40:295–321)
Gordon S, Taylor PR. 2005. Monocyte and macrophage heterogeneity. Nat. Rev. Immunol. 5(12):953–64
Kawai T, Akira S. 2011. Toll-like receptors and their crosstalk with other innate receptors in infection
and immunity. Immunity 34(5):637–50
Chen G, Shaw MH, Kim Y-G, Nuñez G. 2009. NOD-like receptors: role in innate immunity and inflammatory disease. Annu. Rev. Pathol. Mech. Dis. 4:365–98
Rehwinkel J, Gack MU. 2020. RIG-I-like receptors: their regulation and roles in RNA sensing. Nat. Rev.
Immunol. 20(9):537–51
Ablasser A, Chen ZJ. 2019. cGAS in action: expanding roles in immunity and inflammation. Science
363(6431):eaat8657
Takeuchi O, Akira S. 2010. Pattern recognition receptors and inflammation. Cell 140(6):805–20














