
自2015年国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以来,国内医疗器械研发创新活力持续释放。截至2025年1月25日,国家药品监督管理局(NMPA)已批准了321个创新医疗器械产品上市。值得一提的是,其中85个创新医疗器械产品由上海市医疗器械检验研究院(下称“上海医械院”)承检,占比达到26.5%。
医疗器械检验检测是对医疗器械进行检验和评价,以确保医疗器械产品符合相关的法律法规和标准要求,是医疗器械开发及设计、注册过程中不可或缺的环节。而创新医疗器械的快速发展,对检验检测机构的能力构建和服务质量提出了更为严格的要求。
在医疗器械领域,经过中国国家认证认可监督管理委员会(CNCA)认定的检验检测机构多达215家。在助力创新医疗器械注册进程中,上海医械院承检超四分之一,充分发挥了其在服务产业发展与创新方面的积极作用。
在业内看来,上海医械院能够取得如此显著的工作成效,与其近年来始终坚持“检验+标准+科研”三驾马车协同驱动密切相关。
成立于2001年的上海医械院不仅是中国国家认证认可监督管理委员会(CNCA)、中国合格评定国家认可委员会(CNAS)、国家药品监督管理局(NMPA)等有关部门认可的国家级综合性医疗器械检验检测机构,是全国十大医疗器械检测中心之一,也是全国医疗器械标准化技术归口单位和上海市药品监督管理局直属事业单位。
当前,上海医械院下设有源器械检验一所、无源器械检验一所、电磁兼容检验所及器械检验分部等四大检验检测部门,拥有NMPA医用电气设备重点实验室和NMPA呼吸麻醉设备重点实验室;于2024年成功获批“上海市医疗机器人质量检验检测中心”(筹),成为国内首个拥有全面授权的医疗机器人检验检测机构;与上海交大合作获得国家发改委批准“磁共振诊疗高端技术国家工程中心”,并设立监管科学与风险评价分中心。此外,还建立了可靠性研究与试验验证中心、人因工程测试验证中心(可用性)、植入物磁共振成像安全评价中心等。
全环境模拟人因实验室(可用性)
截至目前,上海医械院共获得检验检测机构资质认定授权检测标准1290余项,中国合格评定国家认可委员会认可授权检测标准1360余项(项目/参数18000余项),检测范围涵盖了医疗器械电气安全、生物安全、电磁安全、材料安全和性能检验等各技术领域,并获得欧洲权威认证机构TÜV南德CARAT实验室和美国保险商实验室UL第三方检测数据认可实验室授权。

电磁兼容10米法暗室
专业且丰富的资质能力奠定了上海医械院在推动医疗器械行业发展中的坚实基础,而衍生出的前置服务理念,则成为其提质增效服务创新的不二法门。
早在2017年,上海医械院就建立了创新医疗器械检验的“绿色通道”。通过实行项目化管理,推行专班定制化前置服务,及时联动相关环节部门,确保检验资源有力释放,保障创新医疗器械产品检验“一路快跑”。
“全链条跨前一步,内部形成联动机制。确保全链条上的岗位人员主动作为,提高部门间协同能力,赋能检验检测提质增效,助力产品加速上市。”上海医械院相关负责人介绍道。
上海医械院也是较早启动信息化改革的医疗器械检验机构。从早年的现场窗口排队提交受理纸质资料到目前数字化升级实行电子合同和线上签章系统,打破时间和地域屏障,真正实现全国企业全程网办,全面完成数字化转型。
相关负责人表示:“全流程信息化不仅优化了业务端流程,也为企业快速取得检验报告对接医疗器械注册电子申报信息化系统(ERPS)提供了便利。这是多年来我院积极主动思考创新服务,了解企业需求,与时俱进、不断探索提质增效的体现。”
此外,研检联动也是上海医械院前置服务的重要一环。在实际工作中,通过梳理排摸多渠道了解创新产品、高端医疗器械企业实际困难和需求,做好实时信息分解和关键信息脱敏后,上海医械院有针对性地加强培训指导,助力企业在产品研发定型阶段的综合考量。
医疗器械标准是医疗器械研制、生产、经营、使用和监督管理共同遵守的技术规范,贯穿于医疗器械全生命周期各环节,其重要性不言而喻。自成立以来,制修订医疗器械标准一直是上海医械院的重点工作之一。
目前,上海医械院共归口5个全国标准化技术委员会以及2个全国标准化分技术委员会,占全国医械行业标技委总量的四分之一,在标准化建设方面承担了更多的责任。
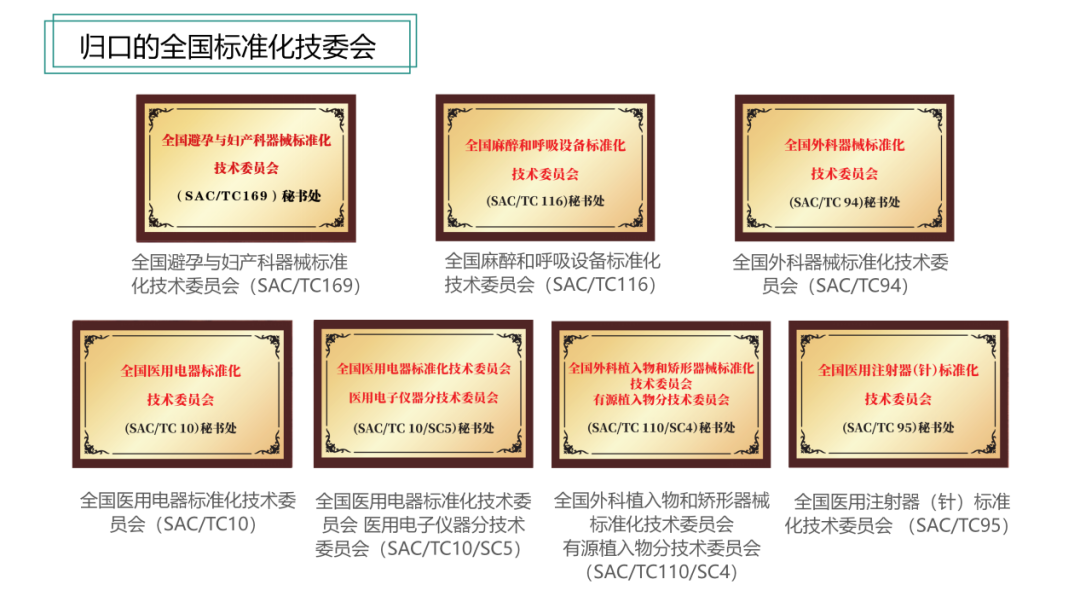
上海医械院归口的全国标准化技委会
近年来,上海医械院依托七个标委会不断开展科学研究、方法开发、持续推动科研成果转化,为标准制修订提供了坚实技术基础。截至目前,七个标委会共有归口标准300项。其中,上海医械院牵头制修订《医用电气设备》系列标准35项,为医用电气设备安全有效和全面升级提供了技术保障,在指导产品生产、规范产业发展和服务政府监管方面发挥了重要作用。
此外,为促进医疗器械标准高质量发展,上海医械院归口的标委会一直紧扣技术和产业的发展趋势,提前布局,加快行动,始终将标准融入技术研发、产业发展和应用迭代等各项工作中。在重点发展方向上,上海医械院也是多点突破、多路并进。
其中,该院正积极开展脑机接口技术领域的标准研究,整体规划了基于通用要求、测试技术、脑机信号、产品应用、医用安全等全面的脑机接口医疗器械标准体系。由该院提出并牵头制定的2份脑机接口医疗器械行业标准已正式获批立项,并为7个创新脑机接口器械研发项目开展了注册前置服务和检验评价工作,为医疗器械领域脑机接口相关项目的布局发展拉开序幕。
而围绕医疗机器人开展相关的标准研究,上海医械院目前已牵头制定了国内首个医疗机器人行业标准YY/T 1712-2021,另有7项行业标准也正在制定中。此外,该院还基于磁共振环境开展植入物磁共振兼容安全性研究和标准体系建设,目前已完成2项磁共振新技术行业标准的立项申报。依托《磁共振环境中植入式心脏起搏器和除颤器的安全要求和测试方法标准研究》项目已制定并发布了YY/T 1935-2024。
植入物磁共振安全性评价中心-1.5T 磁共振设备
为了尽快与国际接轨,缩小与国际标准的差距,上海医械院也积极推荐国内相关专业人员加入国际标准化组织,积极申报并参与国际标准化工作。据介绍,上海医械院累计帮助超过70位国内专家注册成为IEC或ISO国际工作组专家,覆盖40余个国际医疗器械标准化工作组。
不仅如此,2019年以来,上海医械院已组团参加国际会议21次,累计参会人次达到238人次。2024年牵头完成了ISO 7151非切割铰接器械国际标准,贡献中国智慧。截至目前,牵头发布的国际标准共3项,进行中的国际标准牵头2项,参与5项。这些举措和工作推动了我国参与国际标准化工作的广度和深度,并显著提升了我国在国际标准化组织中的影响力。
创新医疗器械产品通常具备独特的技术或结构特性,这要求检验检测机构必须在技术层面进行相应的储备研究。
依托医用电气设备、呼吸麻醉设备两个国家药监局重点实验室,上海医械院深入研究各类医疗器械检验技术,并积极开展科研相关工作。
其中,上海医械院主持科技部数字诊疗装备重点研发项目《医学影像设备可靠性与工程化技术研究及应用》,制定了3项行业标准和7项团体标准。不仅填补了国内医疗器械行业在可靠性技术标准方面的空白,还通过携手知名大学和工信部直属可靠性权威研究机构,联合目前国内最大的两家大型医学影像生产厂家,选择最具有代表性的大型医用影像设备MRI与CT及其核心部件为核心研究对象,开展了有关可靠性工程化及标准化研究,构建可靠性测试平台,形成了医-学-研-产-检的有机循环,构成医疗设备可靠性研究开发到验证的闭环。通过本项目的研究,将促进医疗影像设备行业可靠性水平的提升,从而提升我国医学影像设备乃至医疗器械行业的国际竞争力。
此外,上海医械院多个重点研究领域的项目也取得积极进展。在高端植入式医疗器械的安全评价上,该院已搭建完整的MRI安全性测试平台,构建完整的1.5T和3.0T虚拟人体仿真数据库,形成5大类植入器械的MRI安全评价方案集。这也让上海医械院成为中国唯一具有完整磁共振成像安全性评价能力的检验机构,已具备国际先进水平的研究能力,打破了国外垄断。

1.5T&3.0T射频发生系统
聚焦医疗机器人标准及测试方法研究,上海医械院建立了国内首个提供多领域跨学科融合的医疗机器人测试平台,自主研发相关检测系统,提供全方位测试评价方案,并已形成《采用机器人技术的介入手术控制系统》等3份行标草案,从而完善手术机器人安全关键指标评价系统。
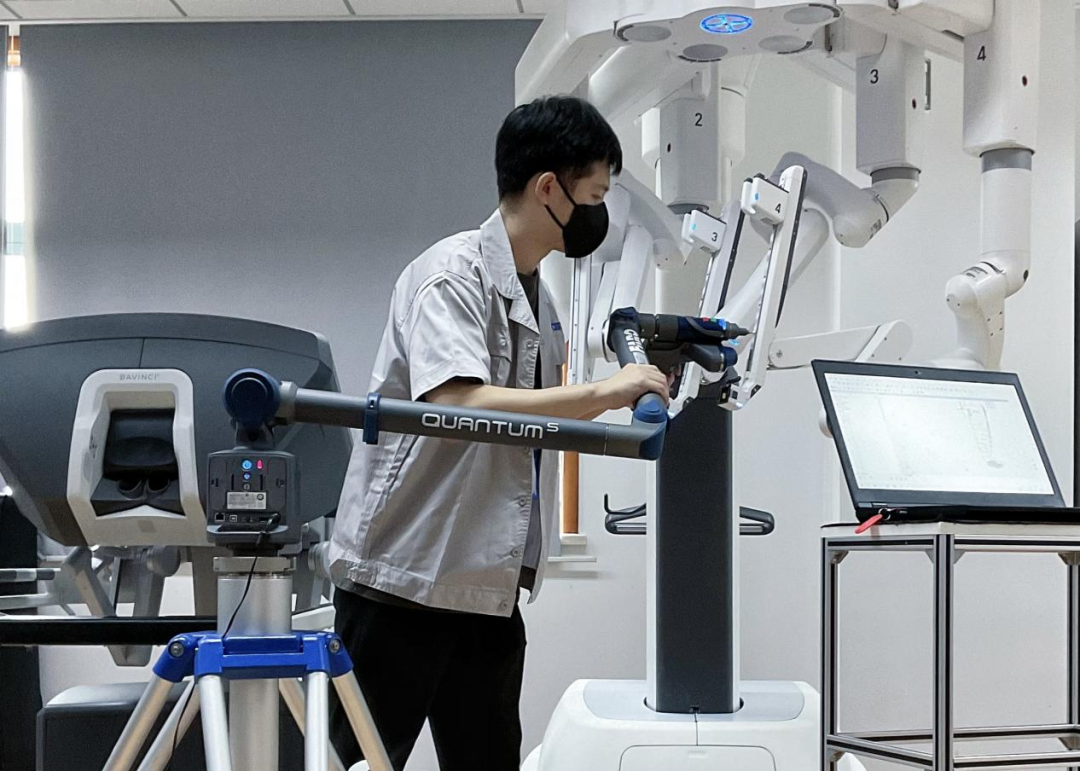
上海医械院医疗机器人检测
2025年,随着国务院办公厅《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》发布,以及《上海市药品和医疗器械管理条例》正式实施,上海医械院将以此为契机,尽快完成新址迁建工作。全面启用23个实验室,建立和完善医用电气设备安全性、电磁兼容安全性、生物材料安全性、理化安全性等四个公共测试平台,通过全方位拓展检验检测、风险评估、科学研究和产业服务“四大功能”,上海医械院将进一步满足产业创新发展和政府监管的需要,迈上发展新台阶。

















