重磅
—中国CFDA加入ICH了,是时候好好研读ICH的相关文件了。正巧前不久看到PDA54-5技术报告,在此节选小部分内容和大家分享。
风险管理在生物制药尤其是规模化生产日趋普遍的今天已经不是一个陌生的概念了,ICH Q9质量风险管理为大家提供了风险管理的基本原则,也给出了各种风险管理的工具,以及风险管理可以应用的领域。4月PDA发布了新的技术报告54-5,该报告是针对实际工作中制造系统生命周期的风险管理的指南,它通过质量管理的最佳实践、风险管理项目的启动、生产系统的设计、调试和确认、质量体系中的风险管理,以及工具模板和两个实际的案例对风险管理在生产系统上的应用进行了详细解读。
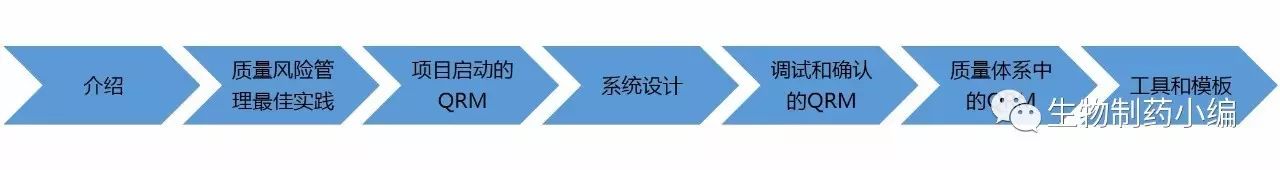
报告在介绍部分指出,ICH Q9提供了标准的对生产系统生命周期进行风险管理的方法-----
风险管理的过程应该从系统设计之初就起始。质量风险管理可以重点用于设计和技术规范的开发上。工艺和产品的知识在整个药品开发项目中不断进化,早期计划有助于从阶段1(工艺设计)中收集合适的数据。在该阶段,质量风险评估的实施是在确认关键质量因子、定义生产工艺和关键工艺参数之后。由于在生产系统生命周期早期可能出现的变化频率,风险评估和确认的控制手段可能需要频繁更新。当确认控制/关键方面来将剩余风险降低到一个可接受的水平时,需要更新生产系统的定义和设计文件。
控制/关键方面(Critical aspects)应该在设计工艺时被引入,在设计回顾/设计确认时进行确认,在安装和操作测试阶段进行确认。应当在整个生产系统生命周期中开展风险回顾和监测,以识别潜在新的风险、再次评估现有风险和确保现有或新控制的有效性。现有风险管理的报告可用于新的生产系统,风险评估应该定期或依据事件为基础根据公司的质量风险管理指南定期回顾和更新。
报告在第三章分享了质量风险管理的最佳实践, 其中包括有效提出和风险相关的问题,问题应该清楚并触发对风险的清晰和全面的理解;其次是风险管理团队应该是来自交叉的不同职能部门,甚至可以邀请组织外的成员如供应商、主要客户或行业顾问,高级管理团队对项目的支持非常重要,团队成员有四类不同的角色,决策、负责、被咨询和被告知;第三个方面是对风险评估的有效和高效管理的考虑,对风险评估工作的充分准备与在整个项目上花的时间和资源是相匹配的。除此之外,这个章节还提及了对风险控制、回顾和沟通环节需要考虑的方面,对实际的风险管理都是非常实用的指导。
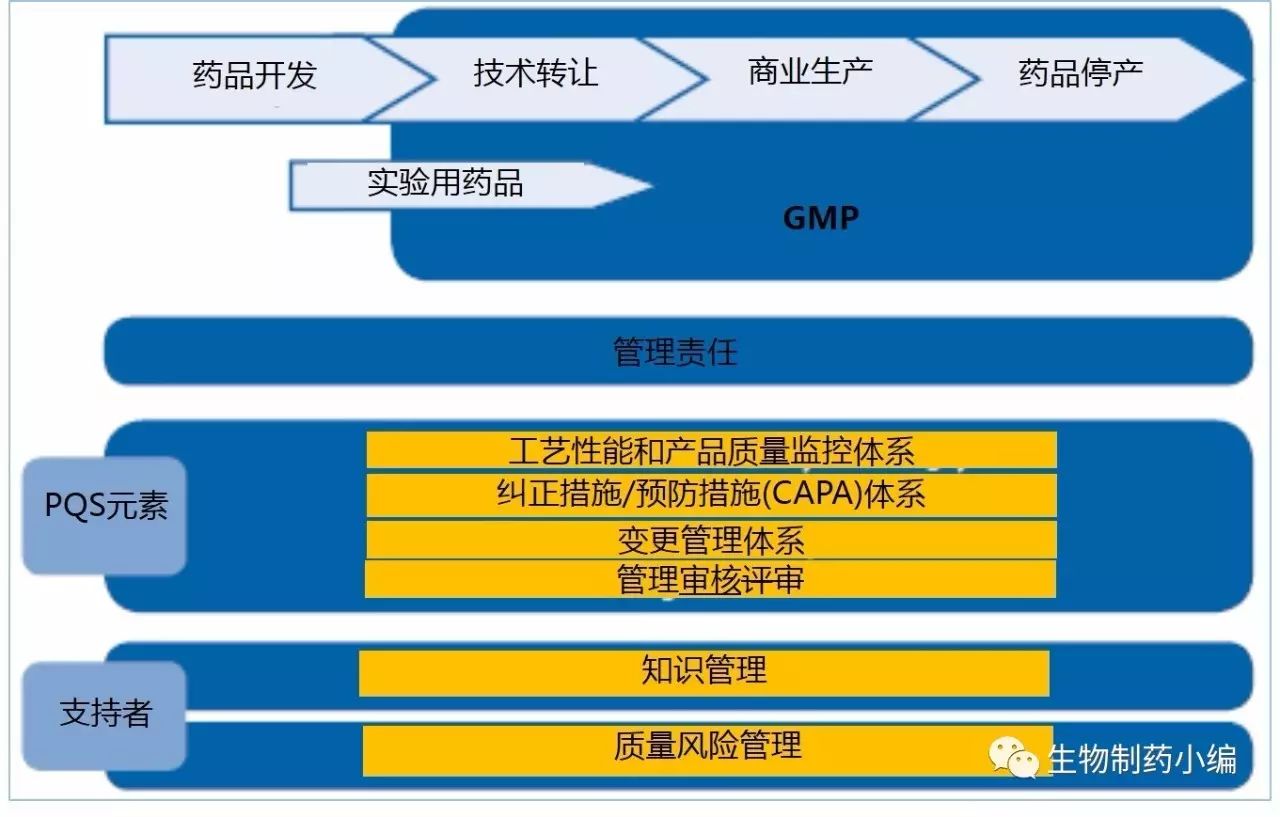
上图是制药质量体系的模型,下图投射了生产系统的生命周期的概念:
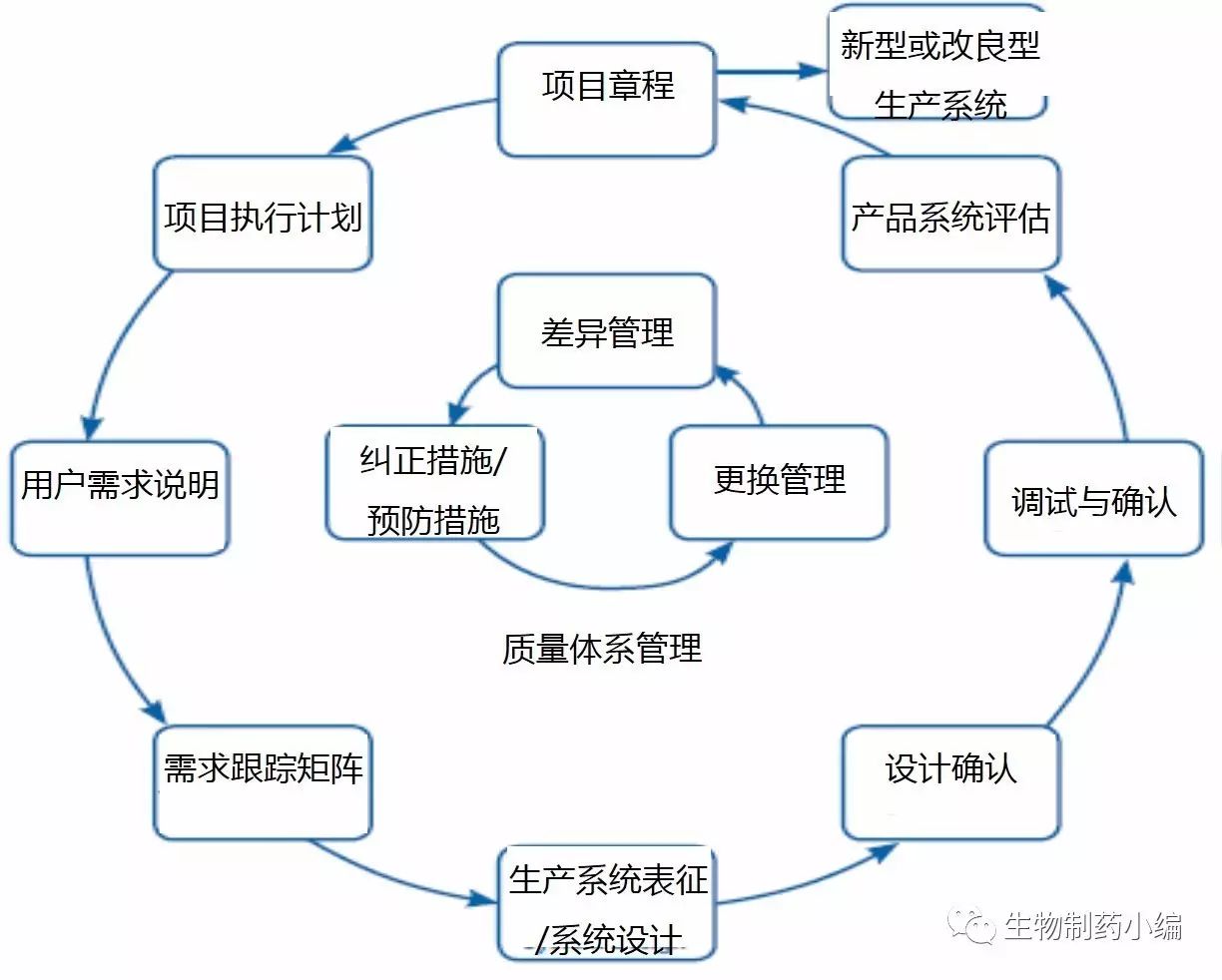
基于这些,明确风险管理的目的和产出及相对应的工具对整个风险管理的实施非常有帮助。下图是对风险管理的目的和输出
:

以下是报告中的案例之一的部分摘录,供大家参考。
制药公司B因为要提高工艺生产能力需要在纯化区域加入缓冲液制备和储液罐,依据公司的流程,引入新的储液罐需要在变更管理体系下进行。作为变更管理的流程的一部分,多个团队对变更进行了评估,包括对整个系统影响的评估(SIA),严重程度评估,以及设计风险评估。选择系统风险评估(SRA)方法(SIA和严重程度评估)是因为相对于工艺风险评估这个方法更适合于制造支持系统。
与引入新的缓冲液配制工艺和储液罐相关联的职能部门,包括质量、运营、工程、维护和验证团队。
系统影响评估-缓冲液配制和储液罐包括带夹套的316L不锈钢罐及相关设备:搅拌桨、除菌空气过滤器、除菌液体过滤器、缓冲液转移泵、控制设备系统包括监测和调节系统压力、温度、液位及监测pH和电导。罐用于配制、储存和供应缓冲溶液。通过系统设计,包括罐体内表面、管道、阀门和所有可能接触工艺流体的表面,可以进行CIP和SIP。
储液罐相关用途总结
1250L带夹套不锈钢罐用于制备和储存1000 L(标称工作体积)的缓冲液,储液罐由可编程序控制器(PLC)和人机界面(HMI)。储液罐上部安装了上搅拌器,缓冲液固体粉末由进料口投料,投料时经过高效空气过滤器的气体向下吹扫,用于保护开口状态的罐体。以下公用设备给储液罐提供WFI, 冷凝水及回水供给,清洁蒸汽和冷凝,厂房蒸汽供给和厂房蒸汽冷凝,CIP。对该生产系统的评估范围包括储液罐,搅拌器、相关系统的管道,隔离阀等等,PLC 和HMI不在这个案例评估的范围内,但是将被分开评估。
用户需求说明
团队对从整体URS中提取出的以下部分进行系统影响评估、严重程度评估和需求跟踪矩阵。
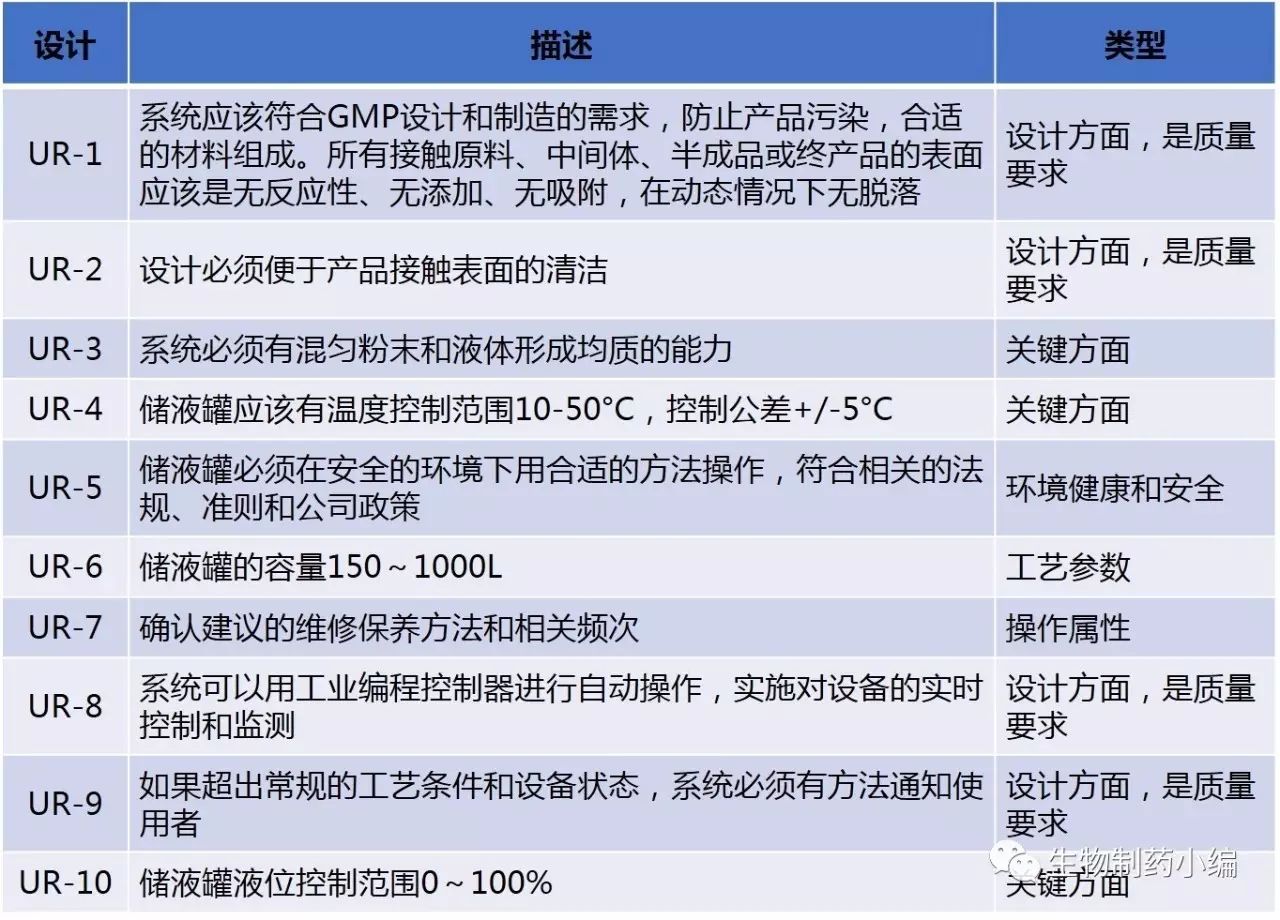
基于系统影响评估结果,团队确定储液罐有GMP影响, 定义它为“impact”系统。下一步就是通过CAs(关键方面)定义和撰写储液罐和它支持的工艺的特殊关系。
GMP Impact assessment requirements (GMP影响评估需求,此处只显示有影响的方面)

关键性评估
团队对关键方面进行分析,通过设计和确认进行更进一步的风险评估。在评估中,团队没有包括非关键的设计方面的风险评估点。
关键性方面的确认
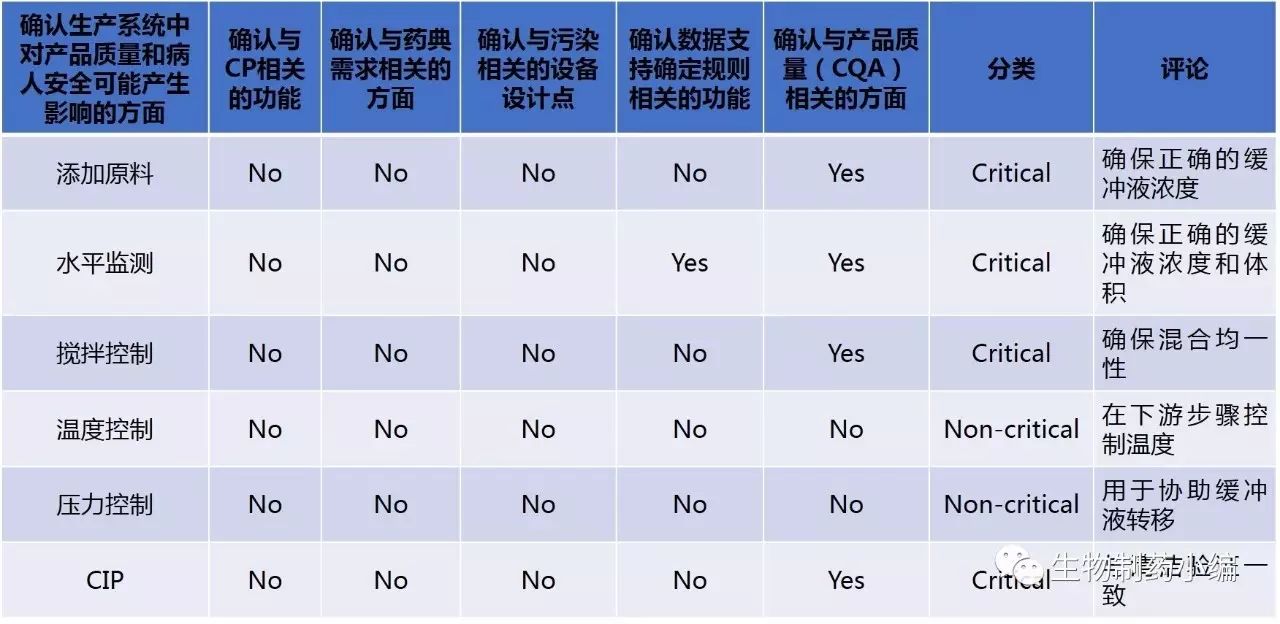
设计风险评估示例
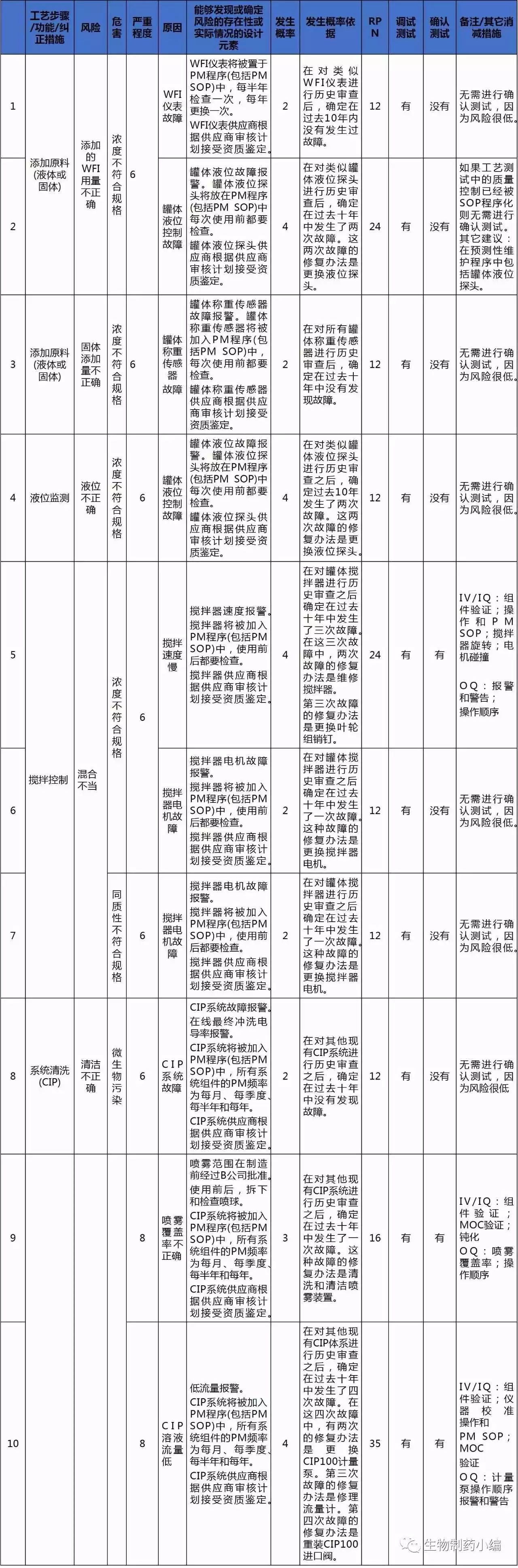
根据GMP影响评估,关键性评估, 设计风险评估最后形成需求跟踪矩阵,完成对此次系统变更的风险评估并确保所有需求都被满足。
小结
应用质量风险管理(QRM)原则和实施可以保证稳定生产高质量的药品服务病患。ICH Q9质量风险管理是一个风险管理的基本原则, PDA 技术报告54 在药品和生物制品生产制造中,对从设计到确认到生产系统操作中如何应用风险管理的原则和工具,提供了更详细的讲解和案例分析,对于生产制造企业的各阶段进行风险管理都是很好的参考文件。对初建厂房购买设备的生产企业尽早引入质量风险管理可以更合理的进行设备的设计和采购,做到最大的投入产出。
主要参考文献
Technical Report No.54-5
Quality Risk Management for the Design,Qualification, and Operation of Manufacturing Systems.
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
wuwj06@163.com






