

中国生物药申报美国IND之路:HLX06(复宏汉霖VEGFR2单抗)篇

2017年6月,复宏汉霖HLX06向CDE递交了IND申请, 9月获得FDA的临床许可。HLX06是由复宏汉霖控股子公司台湾汉霖生技股份有限公司自主研发的的重组抗VEGFR2全人单克隆抗体注射液。
血管内皮生长因子(VEGF)与其受体VEGFR结合传导信号,与血管的生长、通透性及肿瘤的转移相关。VEGFR是class III络氨酸激酶,通常的膜外结构有immunoglobulin-like loop D5、D7,其中VEGFR2与血管生成及淋巴管生成的信号通路有关,当VEGFR2与VEGFA结合以后被激活,两个VEGFR2形成二聚体并完成络氨酸磷酸化,便激活下游带有SH2结构域的信号分子,如PLC-gamma、VRAP、Sck、PI3K等。VEGFR2被认为是VEGF信号通路的主要传递者,且研究发现VEGFR2表达异常或过度活化与很多肿瘤相关,如直肠癌、结直肠癌、胃癌、食道癌、膀胱癌、肺癌等。
VEGF单抗Avastin(bevacizumab)通过靶向VEGFA抑制血管生成从而抑制肿瘤的生长;小分子化药sorafenib、sunitinib、Cediranib等和大分子单抗Ramucirumab则是靶向VEGFR2。其中,Lily的Ramucirumab用于胃癌,结直肠癌及非小细胞肺癌适应症的治疗,2016年全球销售额为6.14亿美元。
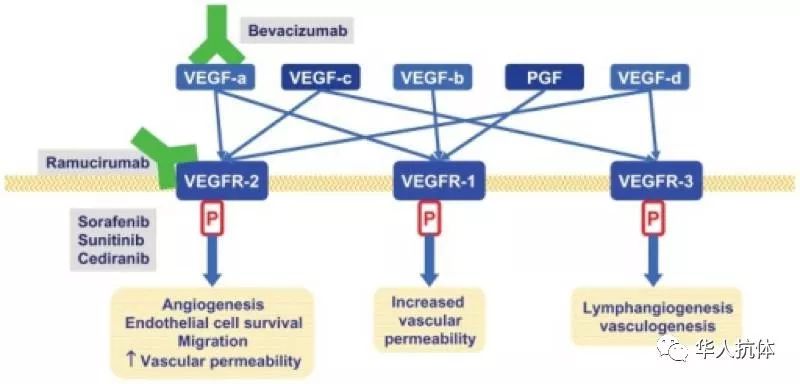
上市VEGF及VEGFR抑制剂作用机理
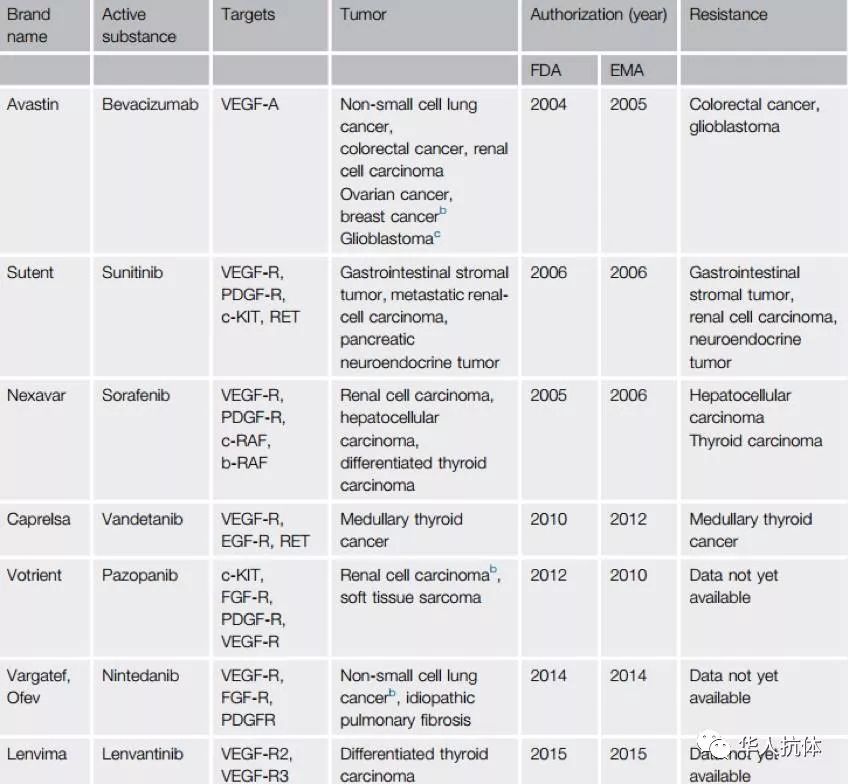
已批准的VEGF & VEGFR靶向药物 (Thomas Simon,2017)
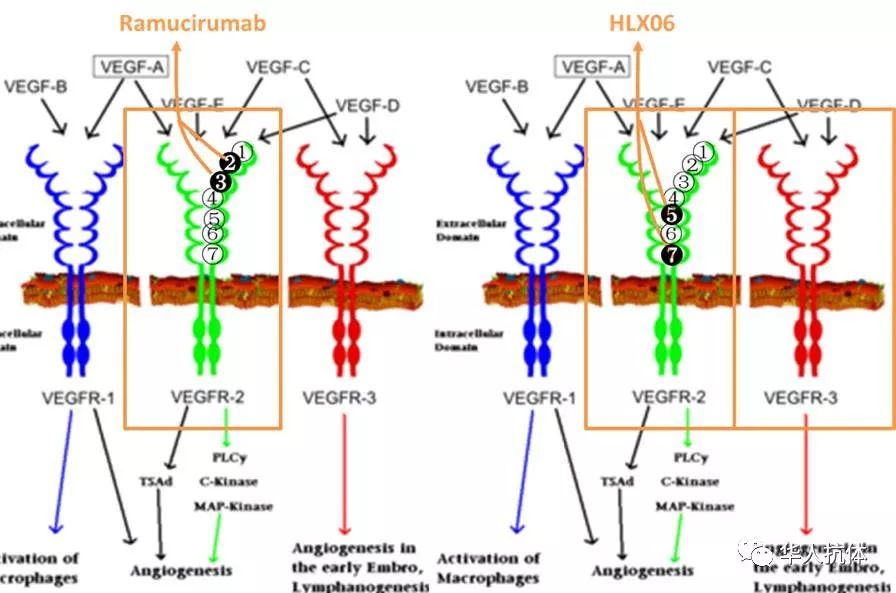
Ramucirumab及HLX-06识别位点比较
从机制上看,Ramucirumab识别VEGFR2的D2和D3;HLX06则是识别VEGFR2的D5和D7,同时可以交叉识别VEGFR3。VEGF的结合位点主要在D1-3,因此Ramucirumab可以低浓度来阻止VEGF和VEGFR2的结合;HLX-06识别的D5和D7的位点则与与VEGFR的磷酸化及二聚体的形成相关。
• 首先以VEGFR2-Fc作为抗原,用人源噬菌体展示文库筛选出十个阳性抗体克隆(V1-V10)
• 然后用ELISA鉴定V1-V10与VEGFR2膜外结合部分,其中V1,V9,V10识别位点为VEGFR2的D5-7。
• 同时通过HUVEC细胞的结合试验(FACs),HUVEC细胞的存活、迁移和增殖试验,血管生成分析试验(sprouting assays, matrigel plug assays)对V1-10进行分析筛选。
• 在HCT-116肠癌小鼠模型中测试V1,V9和V10对肿瘤抑制的效果,选出V9抗体。
• 对V9的CDRL2/CDR-L3/CDR-H3构建亚库,进一步用噬箘体展示技术进行筛选,从77个Fab克隆中选出5个亲和性高于V9的单抗克隆。
• 将这5个克隆构入全长IgG中,再进行轻链和重链的组合得到7个候选者:V9/V9, 29N9 (LC/HC), 34/V9 (LC/HC), 67/V9(LC/HC), 29/34 (LC/HC), 34/34(LC/HC), 67/34 (LC/HC),再从中筛选高亲和性抗体。
• 选出29,34,67三个克隆,并对其CDR-H1/CDR-H2进行构建亚库,继续筛选获得80A, 80B, 86A, 86B, 88, 109,110A 和110B。
• 通过SPR试验及鼠源VEGFR2-Fc筛选获得亲和性最高的110/110B(LC/HC)。
• 进一步试验发现110/110B可以阻断VEGFC与VEGFR2的结合,且可以作用于VEGFR3。
• 在人源NCI-H460非小细胞肺癌小鼠模型中测试34/V9 (LC/HC), 1091109 (LC/HC), 110A/110A(LC/HC)和110B/110B (LC/HC)的抑制肿瘤效果。
110/110B(猜测)变更代号为HLX06
| HLX06(根据专利猜测) | ramucirumab |
CDR-L1 | QSLYYR-D/S-GYTF | RASQGIDNWLG |
CDR-L2 | L/Q/R-SS | DASNLDT |
CDR-L3 | M/LIF-QGTHWPYT | QQAKAFPPT |
CDR-H1 | G/R-FS/T/P-FSTYA | SYSMN |
CDR-H2 | I-S/N-G-S/NG/S-G/Q-A/T-T | SISSSSYIYYADSVKG |
CDR-H3 | KGL WFGEG-Y /LII | VTDAFDI |
部分体外试验结果:
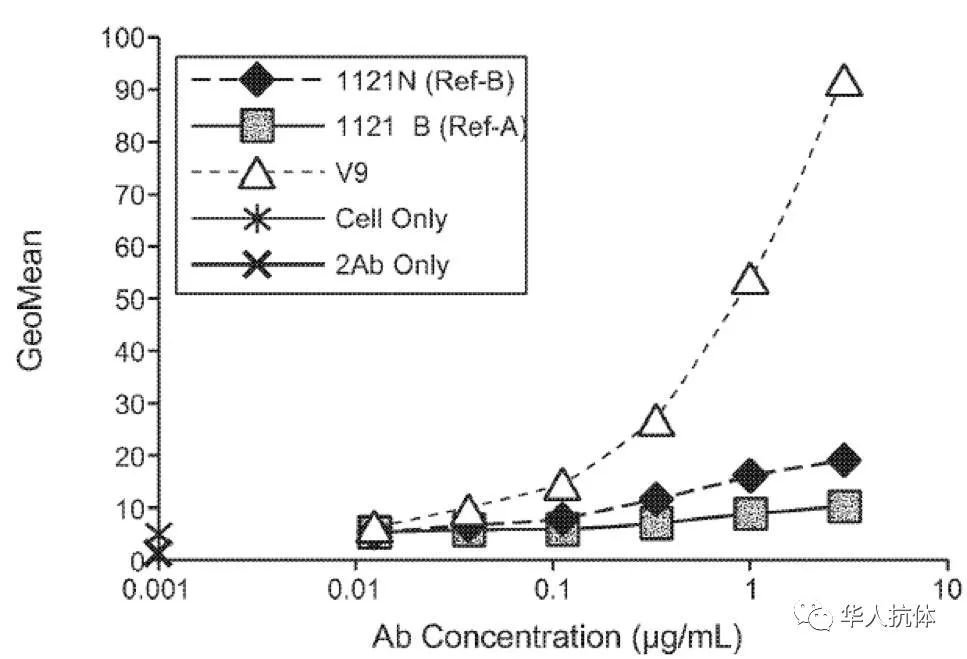
V9比ramucirumab (1121N)对HUVEC细胞有更好的亲和性
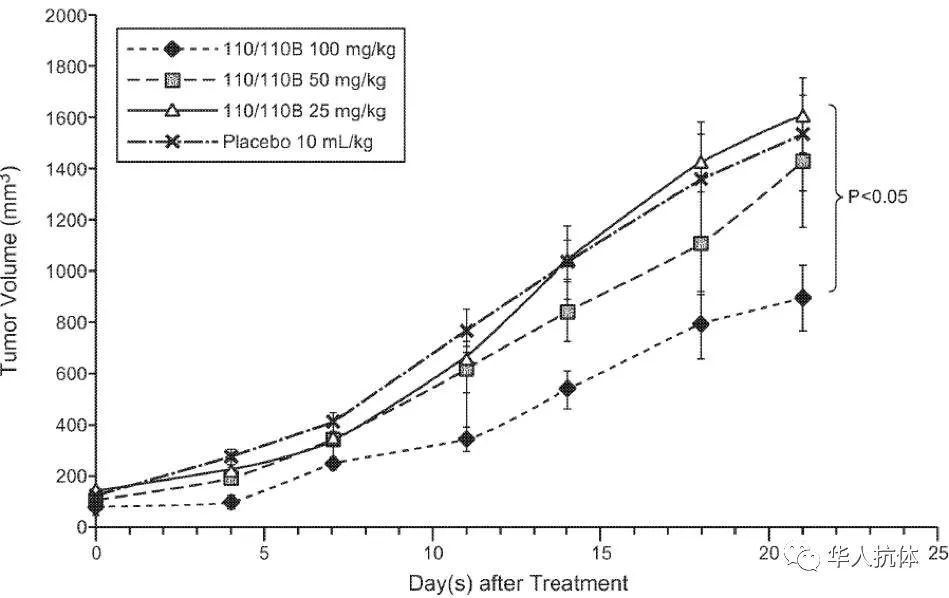
100/100B对人源NCI-H460非小细胞肺癌小鼠模型抑制效果
IND申报需要准备毒理数据、CMC资料和临床试验方案,HXL06的这3个方面的数据来源如下:
• 毒理数据由昭衍完成;
• CMC是由公司自己完成,整个平台运行稳定,配备200L、500L及2000L的发酵罐,根据未来临床试验需要调整。采用CHO生产抗体,目前产量3~4g/L。
• 美国IND申报所准备的临床试验方案由台湾汉霖设计。
Lilly 已在中国登记开展 Cyramza(Ramucirumab)的临床试验,其中包括晚期肝癌、晚期胃癌或胃食管癌,这也是在国内患者数量较多的适应症,目前仍是以化疗药物为主。作为公司的创新型单克隆抗体(Novel mAb)项目暂时还没有在clinicaltrials中注册。而已HLX06临床前试验使用的模型来看,可能首选的适应症为非小细胞肺癌或结直肠癌;另外国内的胃食道癌及食道癌有着明显的差异,笔者认为也可以纳入HLX06临床适应症考虑范围。
Ramucirumab中国临床试验中心登记情况 |
登记号 | 试验状态 | 适应症 | 试验通俗题目 |
CTR20170561 | 进行中 | 肝细胞癌 | 在晚期肝细胞癌患者中比较Ramucirumab与安慰剂的总生存时间 |
CTR20160574 | 进行中 | 胃或胃食管结合部腺癌 | 晚期胃或胃食管结合部腺癌患者中Ramucirumab的3期研究 |
此外,科伦博泰生物和山东步长神州也在进行VEGFR2靶点单抗的研究,并在国内进行新药临床试验的申请。抗体药物开发的成功率及进展速度也与CMC及QC有密切关系,笔者认为复宏汉霖在此有一定的积累和优势。希望HLX06顺利完成1、2、3期临床试验进入市场,优质优价满足国内患者需求。
国内EGFR2单抗申请情况 |
受理号 | 企业 | 申请注册类型 | 阶段 | 时间 |
CXSL1700064 | 复宏汉霖生物技术有限公司 | 国产1类新药 | 申请临床 | 20170713 |
CXSL1700009 | 山东步长神州制药有限公司 | 国产1类新药 | 申请临床 | 20170331 |
CXSL1600119 | 科伦博泰生物医药股份有限公司 | 国产2类新药 | 申请临床 | 20170126 |
[1] 中国生物药申报美国IND之路系列:SHR-1316(恒瑞PD-L1单抗)篇
[2] 中国生物药申报美国IND之路系列:KN035(PD-L1单域抗体)篇
[3]中国生物药申报美国IND之路系列:百济神州PD-1单抗(BGB-A317)差异化开发策略
华人抗体协会

免责声明:华人抗体微信公众号所载的文/图等稿件部分转载/复制于网络。版权均归原作者所有,不代表协会观点。保留转载文章的出处及原刊载媒体上的署名形式和版权声明(如有),但本协会对转载文章的版权归属和权利瑕疵情况不承担核实责任。如任何单位或个人认为本协会转载的文章涉嫌侵犯其合法权益,请及时向本协会提出书面意见并提供相关证明材料和理由,协会在收到上述文件后将采取相应删除措施。

















