更优生物药是指治疗用生物制品蛋白质药物,通过改变物理结构或构象、药物与蛋白质及药物之间的基因融合,达到延长药物半衰期、药物靶向为目的所研制的创新生物药。最有发展前景之一的是白蛋白作为药物输送载体平台技术,形成重组白蛋白融合蛋白更优生物创新药(Biobetters)。为此,本文仅就该白蛋白融合蛋白领域的进展进行简要综述。
人血清白蛋白在人体血液中为最大单一组分蛋白质,血液中的含量约为50g/L,占血浆总蛋白的40%~60%,半衰期长达20d。白蛋白以其稳定的惰性在人体血液中起着不可替代的功能,近年来在临床治疗药物研发中越来越受到重视。
白蛋白融合蛋白自1992年由欧洲科学家率先报道,白蛋白-CD4蛋白质基因融合后在酵母菌中表达,目的是用于HIV的抑制和治疗。临床上,阿霉素衍生物的偶联药物以及白蛋白-紫杉醇纳米颗粒已经完成了临床评价,被批准用于治疗转移性乳腺癌,年销售额可达10亿美元以上;诺和诺德公司的胰岛素十四酸衍生物偶联到白蛋白多肽上的脂肪酸结合位点,形成的新药Levemir已被批准用于糖尿病的治疗,并且成为小儿糖尿病的治疗特效药;2000年底美国人类基因组科学公司(HGS)以1.2亿美元通过并购Principa公司获得了长效化白蛋白融合蛋白药物开发的权利;2013年GSK制药集团的胰高糖素类肽-1白蛋白融合蛋白(阿必鲁肽)成为世界上第一个获得上市销售许可的白蛋白融合蛋白创新药
1994年,作者在美国费城天普大学和汤姆斯杰弗逊大学医学院主持蛋白质表达实验室工作时独立启动了白蛋白融合蛋白用于表达人类基因产物的研究,随后获得美国汤姆斯杰弗逊大学专利技术实施授权书,独立持有白蛋白融合蛋白相关发明和提交专利申请权和专利实施权利的所有权。于在林、富岩夫妇为此创办美国福源集团,并作为发明人独立开展“no-linker白蛋白融合蛋白药物长效化技术平台”建设并形成完整的系列发明专利申请,启动了一系列白蛋白融合蛋白长效化创新药的原创原研工作。2010年月诺华制药集团向美国福源集团子公司天津溥瀛生物技术有限公司发出希望获得中国发明专利(公开号:CN583795A,即中国发明专利号:ZL200410042814.8)的全球专利实施许可的律师函。
2015年天津溥瀛生物技术有限公司获得天津市科委认定成立了中国第一个“天津市长效重组融合蛋白企业重点实验室”专业从事重组人血清白蛋白融合蛋白创新药原创原研工作。
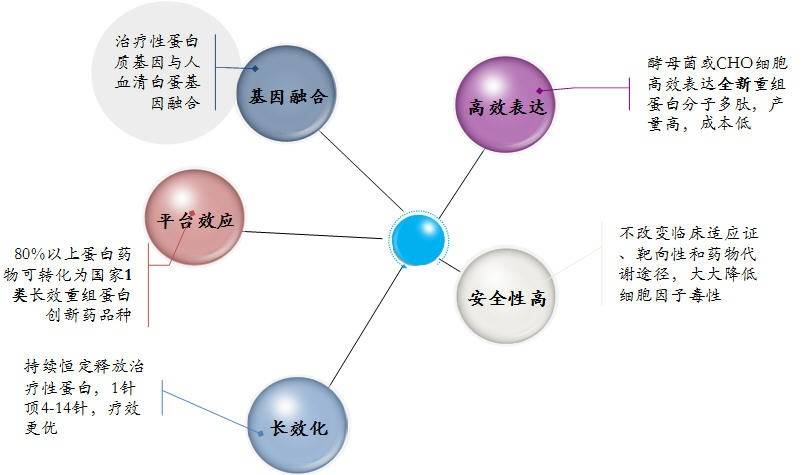
图 1 重组人血清白蛋白融合蛋白技术平台用于研发更优生物创新药的优势及特点
2.1 注射用重组人血清白蛋白/胰高糖素类肽-1融合蛋白(GLP-1)
当人体血液中的糖含量维持高水平而不能被正常代谢的现象,称为高血糖症,是2型糖尿病患者的典型症状。全球有至少2亿名2型糖尿病患者。为控制高血糖,患者需要终身用药。GLP-1具有葡萄糖浓度依赖性降糖作用。GLP-1的这种葡萄糖浓度依赖性降糖特性是其临床应用安全性的基础和保障,从而免除了人们对现有糖尿病治疗药物及方案可能造成患者严重低血糖的担心。
白蛋白与GLP-1融合蛋白是HGS公司开展的一系列长效重组人血清白蛋白融合蛋白中的一个。基因偶联后在S.cerevisiae酵母菌中表达分泌,经分离纯化得到阿必鲁肽,于2014年3月和4月先后获得欧洲、美国批准上市销售。中美福源生物技术(北京)股份有限公司正在开展重组人血清白蛋白/胰高血糖素类肽融合蛋白的临床前研究工作,子公司北京中美福源生物医药科技有限公司提交了“具有持续控制血糖浓度功能的重组人血清白蛋白/胰高糖素类肽融合蛋白”发明专利申请。重组人血清白蛋白/胰高糖素类肽融合蛋白每2周给药1次将具有极为显著的临床优势,成为更优生物创新药的代表。
2.2 重组人血清白蛋白/凝血因子-IX融合蛋白
美国CSL Behring公司生产的商品名Idelvion是世界上第一个被批准的凝血因子类的注射用重组人血清白蛋白/凝血因子-IX融合蛋白产品,这也是世界上首个使用CHO细胞表达系统生产和制备并上市销售的创新药。适用在有血友病B儿童和成年(先天性因子IX缺乏)。CSL公司正在开展其他数个凝血因子的白蛋白融合蛋白长效化创新药研发。预计还将有血友病A治疗和预防用药白蛋白-凝血因子-VIII融合蛋白创新药也将陆续完成临床试验进入市场准入申报阶段。
天津溥瀛生物技术有限公司利用自有知识产权和白蛋白融合蛋白专利技术平台,已经启动了注射用人血清白蛋白/凝血因子-VIII融合蛋白和人血清白蛋白/凝血因子-IX融合蛋白创新药在内的临床前研究。
2.3重组人血清白蛋白/粒细胞刺激因子融合蛋白(rHSA/GCSF)
重组粒细胞刺激因子2010年的全球销售额大于50亿美元,美国市场产品主要是Amgen公司的Neupogen和Neulasta,以及Schering AG’s Leukine。
美国福源集团的白蛋白融合技术在2002年完成重组人血清白蛋白/粒细胞刺激因子融合蛋白表达酵母工程菌构建,并陆续开展成药性研究、药学研究和临床前动物实验研究。2009年天津溥瀛生物技术有限公司申报原创原研的新药《注射用重组人血清白蛋白/粒细胞刺激因子融合蛋白》注册申请。2011年获得CFDA批准开展I-II临床试验的许可批件。目前正在II期临床试验阶段。其子公司天津福盈生物制药有限公司在天津计划投资2亿元,启动了“注射用重组人血清白蛋白/粒细胞刺激因子融合蛋白”的GMP生产基地一期建设。
2.4重组人血清白蛋白/干扰素α融合蛋白(rHSA/IFNα2a和rHSA/IFNα2b)
由HGS公司2010年完成的针对丙型肝炎患者的III期临床试验,所有指标均优于阳性对照药美国罗氏制药集团的Pegasys(派罗欣,PEG化干扰素α2a)。
作者带领的团队在世界上率先开展了“注射用重组人血清白蛋白/干扰素α2a融合蛋白”的临床前研究,2012年获得临床试验许可批件,现已完成Ia期和Ib期临床试验。2015年“注射用重组人血清白蛋白/干扰素α2b融合蛋白”也获得CFDA批准进入临床试验阶段,现结束了Ia期试验,正在开展Ib期试验。
2.5注射用重组人血清白蛋白/促红素融合蛋白(rHSA/EPO)
于在林2002年提交了重组人血清白蛋白/促红素融合蛋白的创新分子结构及用途的美国发明专利申请,其后又在中国提交了发明专利申请。中国发明专利在2006年获得授权,美国发明专利申请则于2008年获得授权。利用CHO细胞表达和制备“不设有连接肽”的重组人血清白蛋白/促红素融合蛋白,经过10余年的研究,2016年7月提交了创新药临床注册申请,获得了CFDA新药注册申报受理通知书。
2.6 正在临床前研究阶段的几个具有成药性的注射用重组人血清白蛋白融合蛋白
2.6.1 重组人血清白蛋白/生长激素融合蛋白(rHSA/GH)
美国HGS公司2002年报道了在大鼠和猴中开展的重组人血清白蛋白/生长激素融合蛋白(Albutropin,rHSA/GH)药代动力学和药效学研究。天津溥瀛生物技术有限公司与中美福源生物技术(北京)股份有限公司的重组人血清白蛋白/生长激素融合蛋白已经进入临床前研究阶段。
2.6.2 重组人血清白蛋白/白介素-11融合蛋白(rHSA/IL-11)
作者研究发明的人血清白蛋白和白介素-11两个蛋白质之间不设有连接肽的融合蛋白(rHSA/IL-11)分子结构获得了中国和美国发明专利授权,目前正在临床前试验阶段。
2.6.3 重组人血清白蛋白/尿酸氧化酶融合蛋白(rHSA/UO)
作者研究和正在开展临床前研究工作的重组人血清白蛋白/尿酸氧化酶融合蛋白。初步的临床前研究工作显示来自酵母菌的尿酸氧化酶生物活性要显著高于人源尿酸氧化酶。由此,进入临床前动物实验安全性评价工作,较大可能是使用来自酵母菌的尿酸氧化酶。
2.6.4 重组人血清白蛋白/白介素-2融合蛋白(rHSA/IL-2)
作者研究发明的人血清白蛋白和白介素-2两个蛋白质之间不设有连接肽的融合蛋白(rHSA/IL-2)分子结构获得了中国和美国发明专利授权。
2.7重组人血清白蛋白/皮肤生长因子融合蛋白外用药和滴眼液的研究
作者首先公开了重组人血清白蛋白融合蛋白作为药物的外用给药的可能性研究工作,试验验证了含有人血清白蛋白(HSA)与多种不同的人皮肤细胞生长因子形成的融合蛋白所构成的各种护肤品,具有比仅含有细胞生长因子单体、或仅含有人血清白蛋白的护肤品有更好的使用效果。融合后的细胞因子在体内和体外具有更长的半衰期和更好的持续作用效果。这种新型的护肤品广泛应用在保健、美容、除皱、祛斑、增白和在美容/整形手术中的创伤或烧伤治疗。
据作者不完全统计,约有60多个治疗用重组蛋白质药物或者功能性蛋白质与人血清白蛋白形成的融合蛋白分别获得表达,部分已经进入成药性研究阶段。
重组人血清白蛋白融合蛋白在过去的10年里研发进程较快,现在世界上已经有2个进入生产和市场销售阶段,作者预计在随后的10年应该有6~10个重组人血清白蛋白融合蛋白创新药会进入市场销售。长效白蛋白融合蛋白创新药必然成为更受药企和社会医保系统欢迎的“绿色药物”。
识别微信二维码,添加生物制品圈小编,符合要求即可有机会进群交流!
注明:姓名+研究方向!


版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制品圈”。















