12月1日是“世界艾滋病日”。艾滋病是本世纪的重大传染性疾病。在其被发现的这35年里,艾滋病波及到了世界的每一个角落,影响到了每一个人种,给人们的健康生活、经济发展和社会稳定都带来了巨大的负面影响。
如今,人类与艾滋病的世纪大战仍在进行,期间有极其丰富的经验和教训,有突出的科技进步和挑战,更有无限的期盼和坚守。我们希望以“世界艾滋病日”为契机,通过回顾历史、分析现状,分享人类认识艾滋病的历程和面临的严峻挑战,普及艾滋病的防治知识,推动临床和基础研究的创新,为最终根治和消灭艾滋病提供科学的思路和参考。
张林琦
(清华大学医学院教授、艾滋病综合研究中心主任)
从上世纪80年代初开始,美国和欧洲相继报告了一种莫名其妙的“新型免疫缺陷综合症”,就是我们今天所说的“艾滋病(AIDS)”。其主要临床表现为外周血CD4+ T淋巴细胞数量和功能严重损失,淋巴结肿大,并伴有卡波氏肉瘤(KS)和一系列的机会性感染,包括卡氏肺孢子虫肺炎(PCP)、巨细胞病毒(CMV)和粘膜念珠菌感染等
(图1)
。流行病学研究表明,大多数病人是具有多个性伴侣、性生活较活跃的男男同性恋。他们主要集中居住在大中城市,以美国的洛杉矶、旧金山和纽约及法国的巴黎为主要代表。当时的美国,肺孢子虫肺炎是严重免疫抑制病人专有的疾病,在健康人群中极其少见。同时,这种“新型免疫缺陷综合症”还在男男同性恋的异性伴侣、静脉吸毒以及一些输过血和血制品的人群中逐渐发现,说明这种疾病很可能是由一种新型病原体导致的全新的传染性疾病。

图1 美国疾病与预防控制中心于1981年发布的“艾滋病发现”的报告
艾滋病发现的同期,世界上多个实验室启动了寻找新型病原体的研究。1983年,法国巴斯德研究所的西诺西和蒙塔尼研究团队,率先从一些同性恋患者体内的T淋巴细胞中分离出具有逆转录酶活性的病毒。由于逆转录病毒在正常人体极其罕见,两位法国科学家推测他们分离出的这种病毒,很可能是新型免疫缺陷综合症的元凶。该病毒经美国国家癌症研究中心罗伯特·加洛教授确认,是一种新型的人类逆转录病毒
(图2)
。1988年,该病毒被命名为人类免疫缺陷病毒I型(HIV-1),也就是我们今天所说的艾滋病病毒。2008年的诺贝尔生理学/医学奖授予了法国科学家西诺西和蒙塔尼,以表彰他们在该领域的重大发现。

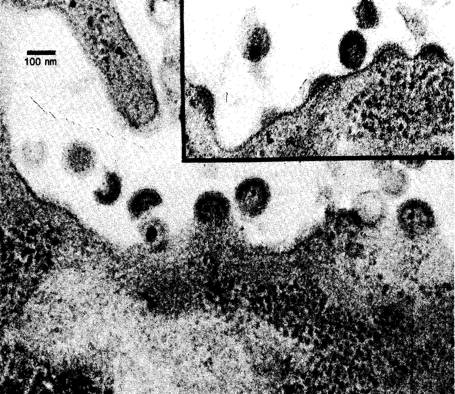
图2 1983年,在美国《科学》杂志相继发表的有关分离艾滋病病毒的代表性文章(上)和当时电镜下观察到的病毒和感染的淋巴细胞(Science 220:868,May 20,1983)(下)
艾滋病是HIV-1感染引起的以CD4+ T淋巴细胞免疫功能缺陷为主的一种综合性免疫缺陷疾病。它致使整个人体免疫功能遭到破坏,最终丧失对各种疾病的抵抗能力而导致死亡。HIV-1在感染者体内的复制以及感染者的临床表现,大概可分为三个时期,第一是感染与扩增期,第二是动态平衡期,第三是急剧复制与扩增期。这三个时期与临床上所说的急性期、慢性期和终末期相对应
(图3)
。第一期,由于HIV-1特异性的免疫反应还未产生,HIV-1在体内的复制与扩增速度很快,在短短的2-3周内,血浆中HIV-1的数量就可以高达每毫升10
6
-10
7
,并伴有外周血CD4+ T淋巴细胞数量快速下降。第二期,免疫系统的激活对HIV-1的复制和扩增产生了很强的抑制作用。这种抑制作用和HIV-1的复制在一定程度上达到平衡,可持续大约10年左右,反应在血浆中HIV-1数量上大约为每毫升10
3
-10
4
。这种HIV-1数量上的平衡,不是绝对静止的平衡,而是HIV-1的不断产生和被清除的平衡。期间,CD4+ T淋巴细胞持续下降。第三期,由于HIV-1的长期感染与复制,CD4+ T淋巴细胞数量下降至每微升血小于200个,导致免疫系统全面衰亡殆尽,HIV-1进入急剧复制与扩增期,反应为血浆中HIV-1数量的急剧上升。最终,诱发多种机会性感染和肿瘤导致病人死亡。
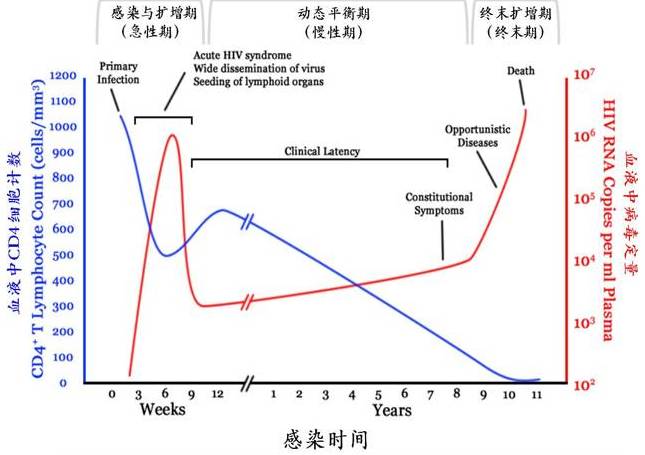
图3 HIV-1感染的自然疾病进程
此外,HIV-1在体内复制的动力学不仅仅是数量上的变化,还伴随着基因序列以及相应的生物学特征的变化。第一期,HIV-1在基因序列上彼此之间相差不大。主要是由于成功感染新个体的HIV-1,在时间和空间上有复制和扩增的优势。第二期,HIV-1在血浆中数量的表观平衡,实际上是HIV-1高水平复制和高速度被清除的动态平衡过程。随着高水平的复制,HIV-1的变异程度加大,导致感染者体内几乎没有基因序列相同的病毒存在。第三期,由于免疫系统的衰亡,使得整个HIV-1群体在体内的复制与扩增加剧,HIV-1呈现更加多样性的特点。值得一提的是,世界范围内流行的HIV-1,具有显著的基因多样性。非洲种类最多,欧美相对单一,我国和东南亚种类逐渐增多。此外,不同感染者之间和同一个感染者的不同感染时期的病毒,均在病毒基因序列上有很大的区别。此外,同一个体,可以被多种HIV-1感染,并由此导致病毒之间的重新组合,产生出变异更多的HIV-1,增加了病毒的多样性,增加了免疫系统的负担,为病毒逃逸免疫和药物识别,提供了关键的遗传学基础。
艾滋病病毒属于逆转录病毒科的慢病毒亚科,目前已发现两种,即在全球蔓延的I型(HIV-1)和限于在西部非洲的II型(HIV-2)。在致病性和传播力方面,HIV-1远远强于HIV-2,全球99%以上的艾滋病由HIV-1所致。
我国与世界其它地区流行的HIV-1有着明显的遗传学特点。欧美主要以B亚型为主,非洲是多种亚型同时流行,而我国主要以B’、B’/C和A/E亚型为主。近几年,随着我国艾滋病流行趋势从高危人群向一般人群的扩散,特别是从静脉吸毒和非法采供血向异性和同性性传播的转变,我国HIV-1主要流行株逐渐被A/E亚型取代。
HIV-1体内的靶细胞主要包括表达CD4受体的T淋巴细胞、巨噬细胞和树突状细胞。感染过程主要包括病毒进入细胞、病毒在细胞内的复制以及最后的装配释放
(图4)
。在感染靶细胞时,HIV-1首先利用其衣壳上的囊膜糖蛋白gp120与靶细胞表面的CD4受体结合(第一受体),使病毒得以附着在细胞表面并诱导gp120产生一系列的空间构象变化,促进gp120再与趋化因子受体CCR5 或CXCR4结合(第二受体)。有趣的是,有些个体由于第二受体CCR5基因天然缺失32个碱基,而对HIV-1感染产生抗性。这些个体主要集中在白人群体,并以北欧的白人比例最高。随后,结合了第一和第二受体的gp120,使病毒另一囊膜蛋白gp41得以暴露。gp41自身穿透细胞膜,将HIV-1牢牢地固定在细胞上,并通过形成超螺旋结构拉近和诱导病毒膜与靶细胞膜的融合,将HIV-1基因组注入靶细胞内。HIV-1与靶细胞融合后便脱去衣壳,形成逆转录复合体,在HIV-1逆转录酶的催化下合成双链DNA,并进一步形成HIV-1整合前复合体,通过核孔进入细胞核。在病毒整合酶的作用下,HIV-1的DNA被整合到靶细胞的基因组中。当靶细胞处于激活情况下时,整合在靶细胞基因组中的HIV-1的DNA利用细胞的转录系统产出大量病毒RNA,并以病毒RNA为模板在细胞质内翻译成Gag、Pol和Env等多个HIV-1结构和调控蛋白,经病毒蛋白酶剪切处理后生成各种毒粒蛋白,在出芽部位的膜上装配成成熟的病毒,并以出芽方式释放,最终形成新一代HIV-1颗粒。
需要强调的是,HIV-1在感染和复制的过程中,最突出的特点是其逆转录酶介导的逆转录活性和整合酶介导的整合活性。
前者提供了病毒变异的遗传学基础,使其成为免疫系统和药物难以追踪的移动靶标;后者促进病毒基因组整合到细胞基因组内,使其变成人体细胞无法清除的组成部分,从而利用人体细胞达到其繁衍生息的工具。
这二者是我们根治艾滋病的最大障碍之一。
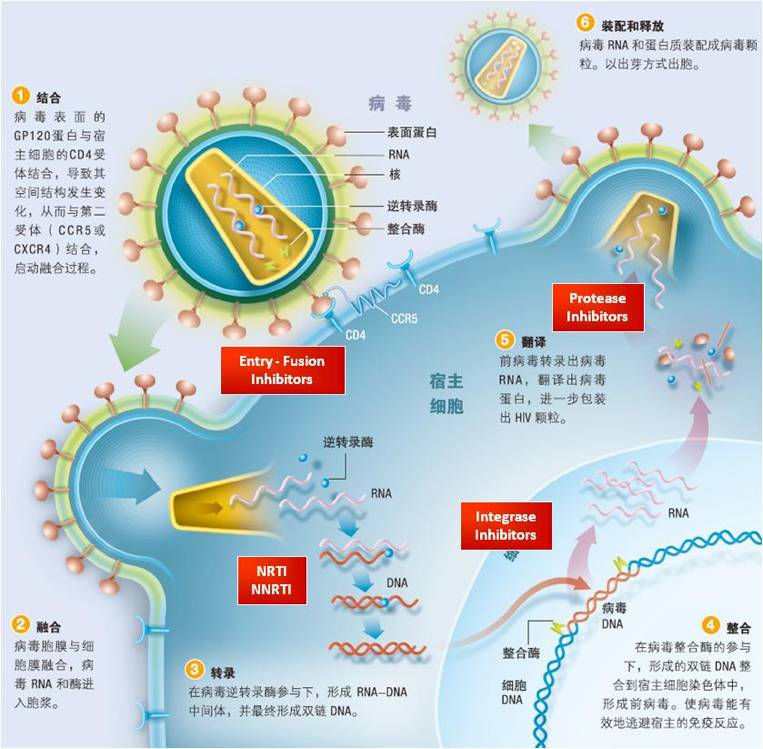
图4 HIV-1的复制过程及药物作用的靶点(红色)
针对病毒在细胞复制过程中的关键步骤,人们成功研发了30多种高效的抗艾滋病药物
(图4)
。这些药物可分为以下5大类:1)病毒进入抑制剂;2)核苷类逆转录酶抑制剂(NRTIs);3)非核苷类逆转录酶抑制剂(NNRTIs);4)整合酶抑制剂;5)蛋白酶抑制剂(PI)
(图4)
。
目前临床广泛使用的治疗方案,是至少三种药物的组合,常用的一线推荐方案是二种核苷类逆转录酶抑制剂加上一种非核苷类逆转录酶抑制剂、或有利托那韦激动的蛋白酶抑制剂,或整合酶抑制剂。这些治疗方案可以将HIV-1抑制到在血浆、精液等检测不到的水平,维持或恢复人体免疫功能,延长患者的寿命、提高生活质量,减少HIV-1的传播。
遗憾的是,目前抗病毒治疗还无法根治艾滋病,会带来不同程度的药物毒副反应,诱导产生耐药毒株。尽管如此,它仍是经实践证明的最为有效的治疗控制手段。
自从1995年高效抗病毒联合疗法(鸡尾酒疗法或HAART)被采用以来,艾滋病发病率和死亡率持续降低了70%,使一种判了死刑的疾病,转为一种可以治疗的慢性疾病。
但是,受到专利和昂贵价格等方面的限制,高效抗病毒联合疗法对于第三世界的绝大多数艾滋病病人来说,是可望而不可及的事情。自2003年我国启动免费抗病毒治疗以来,数以万计的感染者已得到了免费治疗,大大提高了感染者的健康水平和生活质量,也大大降低了传播几率。
需要指出的是,由于专利等多种原因,我国的抗艾滋病药物的种类和使用的便捷程度,比起世界上发达国家还有较大的距离。加之部分感染者的依从性较差,直接导致耐药株的出现与传播。据最新的研究显示,部分地区的耐药率已经超过20%,这使我国本来就非常有限的抗艾滋病药物在这些病人中失去疗效,并增加了耐药株传播的风险。
现有的抗艾滋病药物暴露出了一些不足之处。比如:1)无法彻底从体内清除艾滋病病毒,致使停药后病毒载量急剧反弹,因此病人必须终身服药;2)不同的药物有不同的毒副作用,如恶心、呕吐等消化道反应,骨髓抑制导致血色素下降、肝功能损伤,体内脂肪代谢部分紊乱,皮疹、眩晕、多梦等程度不等的不良反应;3)具有广泛的耐药性问题,不能单独或二药使用,必须是至少三种或以上的药物联合使用。艾滋病病毒一旦产生耐药突变,对同一类药物还可能有交叉耐药反应,由此导致整个类别药物药效丧失;4)与很多其他的药物有药物相互作用,如可以使抗结核药物利福平的血药浓度大大下降,使得联合配药与用药过程相当复杂,直接导致病人依从性差,治疗达不到预期效果等。现有药物的这些不足之处迫使人们不断探索HIV-1新的治疗靶点及新的综合治疗方案。
如上所述,HIV-1变异和整合是根治艾滋病的最大障碍之一。不仅如此,携带整合病毒的细胞还可以形成“静止”状态,从而逃逸人体免疫和药物的识别,而达到潜藏的目的。精确诊断、激活和清除这些潜藏细胞才能达到“根本的治愈”。从现有的技术和能力上看,我们正在逐步锁定这群细胞,并通过更加精准的“激活”和“杀伤”方法,力争清除这些潜藏的细胞,但目前离根治的终极目标仍有相当的差距。
但是,一个“柏林病人”的病例提示了利用其他手段可达到根治目标的可能。这位“柏林病人”感染HIV-1十几年,一直接受药物治疗,虽然其血液中的病毒得到了有效控制,但仍然有潜藏的HIV-1存在。不幸的是,他又被诊断出白血病,被两种“绝症”困扰着。其医生决定对其进行骨髓移植治疗,并大胆推则,如果能从骨髓配型的捐献者中找到一个HIV-1第二受体CCR5的缺失者,其CD4+T淋巴细胞将会天然地抵抗HIV-1的感染,最终使得该病人在接受为了治疗白血病而实施的骨髓移植手术后,其体内的艾滋病毒也可能跟着一起消失。后来,这个推测得到了证实,“柏林病人”在治疗三年后,体内的HIV-1彻底消失了,成为世界上第一个也是唯一一个根治了艾滋病的感染者。这一结果被分别发表在世界著名的《新英格兰医学》和《血液》杂志上,引起了全世界的震惊
(图5)
。需要指出的是,这种治疗方法虽然有效,但找到CCR5缺失者骨髓及配型的机遇少得可怜,再考虑到骨髓移植本身的高昂费用和手术风险,不具有推广的普遍意义。
但科学家们认为,“柏林病人”提出了一种潜在的根治艾滋病的新思路。如果能够通过有效的手段把骨髓造血干细胞或T淋巴细胞的CCR5基因敲除并回输给感染者,那么,这些细胞会在体内免受HIV-1的感染,正常复制及行使功能,继而渐渐取代已被HIV-1感染的T淋巴细胞,从而达到根治的目标。
新一代的基因编辑技术和应用,一定能在艾滋病根治的方向上发挥关键的作用。
此外,在根治艾滋病极其困难的前提下,科学家们还提出了“功能性治愈”的目标,即通过多种治疗和干预手段,达到对病毒的一种长期稳定的控制状态,即使停药之后,病毒量也不反弹。针对这个目标,多种研究策略正在研究之中,包括极早期抗病毒药物治疗、免疫治疗和治疗性疫苗等等。

图5 “柏林病人”的艾滋病得到根治的结果被分别发表在《新英格兰医学》和《血液》杂志上
从艾滋病病毒被发现的那天开始,研发一款安全有效的艾滋病疫苗一直是科学家们研究的重中之重,这是从根本上阻断艾滋病病毒传播最有效的预防措施。但由于我们对艾滋病病毒本身高度变异和灵活的逃逸机制、免疫保护机制以及可靠的动物模型等重大科学难题缺乏根本的认识和基础,致使艾滋病疫苗的研发一直困难重重,步履蹒跚,进展非常缓慢。
例如,我们至今仍然不清楚HIV-1是如何杀伤起关键免疫作用的CD4+T淋巴细胞的,为什么人体无法产生广谱有效的抗艾滋病病毒的免疫反应,为什么艾滋病病毒可以在人体细胞内隐蔽起来不被免疫系统抑制等等。
在过去几年中,我们在临床和基础科研方面取得了长足的进展,特别是2009年由美国国立卫生研究院与泰国共同主持的代号为RV144的艾滋病疫苗人体试验,显示痘病毒和重组蛋白的“初免与加强”联合免疫策略,在受试者中起到了31%的抗HIV-1的保护性作用,这是前所未有的成果。尽管仍然存在很多问题,但不能否认RV144试验对疫苗研发领域带来了曙光,也对疫苗研发方向起了指导作用。后续的5400例人体验证试验(HVTN702)近期已在南非进一步展开,预计2020年获得试验结果。
此外,在发现HIV-1相对保守的位点方面,研究人员取得了重大的突破。从有效控制病毒复制的感染者中,成功分离出多株具广谱中和能力的单克隆抗体,可以抑制高达世界上95%以上的HIV-1毒株。通过对这些抗体与病毒结合位点的结构分析,发现多个病毒表面蛋白的薄弱位点,比如囊膜蛋白的可变环(Variable Loops,VP)V1、V2和V3,CD4结合位点(CD4 binding site,CD4bs),CD4结合后而诱导出的位点(CD4 induced,CD4i)及近膜区(MPER)等
(图6)
。这些薄弱位点的发现,为疫苗和药物设计提供了更加精准的靶标。最新的研究结果显示,这些广谱中和抗体在治疗和预防艾滋病传播中,发挥着重要的作用。此外,一种以这些靶标作为疫苗设计和研究策略的“反向疫苗学”概念和学科也因此应运而生。我国科学家在国家传染病重大专项的支持下,积极探索艾滋病疫苗研发的新思路,力争在世界上率先研发成功艾滋病疫苗,为艾滋病的防治作出突出贡献。
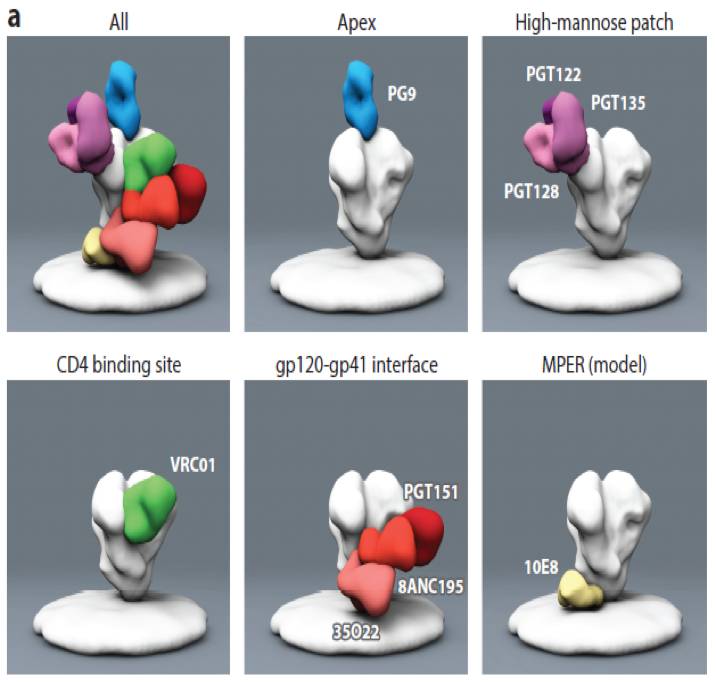
图6 广谱中和活性抗体与病毒结合位点的结构分析(Burton and Hargartner, Annu Rev Immunol,2016)
虽然我们在艾滋病防治等领域取得了突出的成绩,但艾滋病仍然在全世界继续蔓延,在我国的流行趋势日益严重。艾滋病也仍然是不治之症,根治和“功能性治愈”在短期内均无法实现,艾滋病疫苗也任重道远。在科学家全力以赴冲击新的基础和临床前沿挑战的同时,艾滋病的预防无疑是重中之重,“防患于未然”必须成为我们与艾滋病较量的第一法宝。这就迫切要求我们严肃面对严重的艾滋病流行现状和发展趋势,加大宣传教育,加强监管措施,普及健康的生活方式,有效防治艾滋病的进一步蔓延。只有这样协同一致,我们才能在与艾滋病较量的世纪大战中胜出,才能最终实现“没有艾滋病的世界”之梦想。
投稿、授权等请联系:
iscientists@126.com
您可回复"年份+月份"(如201510),
获取指定年月文章,
或返回主页点击子菜单获取或搜索往期文章。
赛先生
由百人传媒投资和创办,
文小刚、刘克峰、颜宁
三位国际著名科学家担任主编,告诉你正在发生的科学。
上帝忘了给我们翅膀,于是,科学家带领我们飞翔。
微信号:
iscientists

▲
长按图片识别二维码关注我们





