摘
要:
目的
通过体内外实验,探讨人参糖蛋白对阿霉素心脏毒性的保护作用及机制。
方法
建立
SD
大鼠心肌损伤模型,给予人参糖蛋白进行干预后,检测血清中乳酸脱氢酶(
lactate dehydrogenase
,
LDH
)、肌酸激酶同工酶
MB
(
creatine kinase isoenzymes-MB
,
CK-MB
)、超氧化物歧化酶(
superoxide dismutase
,
SOD
)活性及谷胱甘肽(
glutathione
,
GSH
)水平;采用苏木素
-
伊红(
HE
)染色法观察大鼠心肌组织病理变化。建立心肌细胞
H9c2
损伤模型,采用
CCK-8
法检测
H9c2
细胞活力;通过流式细胞术检测
H9c2
细胞周期、细胞凋亡、活性氧(
reactive oxygen species
,
ROS
)水平和线粒体膜电位变化;采用
Western blotting
法检测
H9c2
细胞凋亡相关蛋白、丝裂原活化蛋白激酶(
mitogen-activated protein kinase
,
MAPK
)信号通路相关蛋白、沉默信息调节因子
2
相关酶类
3
(
silent mating type information regulation 2 homolog 3
,
Sirt3
)的表达情况。
结果
心肌损伤大鼠模型中,
模型组大鼠心肌纤维排列紊乱,肌纤维严重变性,
LDH
和
CK-MB
活性显著升高(
P
<
0.01
),
SOD
活性和
GSH
水平显著降低
(
P
<
0.05
、
0.01
)
;与模型组比较,人参糖蛋白高剂量组心肌肌束排列较为整齐,
LDH
和
CK-MB
活性显著下降(
P
<
0.05
),
GSH
水平显著升高(
P
<
0.05
),
人参糖蛋白对阿霉素所致的心肌组织病理学损伤有明显修复作用。细胞损伤模型中,模型组细胞存活率显著下降(
P
<
0.001
),细胞周期阻滞于
G
1
期(
P
<
0.01
),细胞凋亡显著升高(
P
<
0.01
),
ROS
水平显著升高(
P
<
0.01
),
线粒体膜电位显著下降(
P
<
0.01
),
Sirt3
、
Caspase-3
、
B
淋巴细胞瘤
-2
(
B cell lymphoma-2
,
Bcl-2
)
蛋白表达水平显著降低(
P
<
0.01
),
Bcl-2
相关
X
蛋白(
Bcl-2 associated X protein
,
Bax
)
、
细胞色素
C
(
cytochrome C
,
Cyt C
)
、
c-Jun
氨基末端激酶(
c-Jun
N
-terminal kinase
,
JNK
)
、
p38
、
细胞外调节蛋白激酶
1/2
(
extracellular regulated proteinkinases 1/2
,
ERK1/2
)
蛋白表达水平显著升高(
P
<
0.05
、
0.01
);与模型组比较,人参糖蛋白组细胞存活率显著升高(
P
<
0.05
、
0.01
),细胞增殖周期恢复,细胞凋亡率显著降低(
P
<
0.05
),
ROS
水平显著降低(
P
<
0.05
)
,线粒体膜电位显著升高(
P
<
0.05
)
,
Sirt3
、
Caspase-3
、
Bcl-2
蛋白表达水平显著升高(
P
<
0.05
),
Bax
、
Cyt C
、
JNK
、
p38
、
ERK1/2
蛋白表达水平显著降低(
P
<
0.05
)。
结论
人参糖蛋白能够通过抗氧化应激、降低线粒体膜电位、提高
H9c2
细胞内
ROS
水平并调控
MAPK
信号通路抑制细胞凋亡,从而保护阿霉素诱导的心肌损伤。
阿霉素为高效广谱的抗生素,广泛用于治疗多种癌症
[1-4]
。与肾脏、肝脏和大脑相比,阿霉素对心肌的亲和力更高;阿霉素会引起心肌收缩功能障碍和心力衰竭,产生自由基损伤心脏,极大限制了其临床的应用
[5-6]
。阿霉素诱导心脏的损伤与临床心肌疾病的病理表现相似
[7]
。
人参具有抗损伤、抗衰老、抗氧化、增强免疫力等药理作用
[8-11]
。人参中含有皂苷、多糖等活性成分,课题组前期从人参中提取了具有生物活性的人参糖蛋白
[12-13]
。人参糖蛋白具有改善记忆功能、治疗老年痴呆、镇静、催眠等作用
[14-17]
,由于糖蛋白具备糖类和蛋白质的双重特性,其生物活性较好。以人参为代表的中药由于其安全性和多靶点的优势,在保护心肌损伤方面有着重要的作用,目前人参糖蛋白对阿霉素所致的心脏毒性作用研究尚无报道。本研究探究人参糖蛋白对阿霉素所致心脏毒性的保护作用及机制,为其抑制阿霉素诱导的癌症患者心脏毒性提供依据。
1
材料
1.1
动物
SPF
级雄性
SD
大鼠
50
只,体质量(
220
±
10
)
g
,
8
周龄,购自吉林省实验动物质量检测中心,动物许可证号
SCXK
(吉)
-2018-0007
。动物于温度(
20
±
5
)℃、湿度(
45
±
10
)
%
条件下饲养。动物实验经长春中医药大学伦理委员会批准(批准号
2020208
)。
1.2
细胞
大鼠心肌细胞
H9c2
购自广州赛库生物技术有限公司。
1.3
药物
人参糖蛋白由长春中医药大学中药药剂实验室自制,中性碳水化合物质量分数为
11%
、酸性碳水化合物质量分数为
4%
、蛋白质质量分数为
82%
;相对分子质量为
8000
~
44 000
,平均相对分子质量为
19 994
,具体结构及质谱图参见文献报道
[10-15]
。
盐酸阿霉素(质量分数≥
99%
,批号
D8740
)购自北京索莱宝科技有限公司;氯化钠注射液(批号
1812380721
)购自辰欣药业股份有限公司;卡托普利片(
25 mg/
片,批号
63181201
)购自上海信谊天平药业有限公司
。
1.4
试剂
DMEM
高糖培养基(批号
81220286
)、胎牛血清(批号
42G2095K
)购自美国
Gibco
公司;磷酸缓冲盐(
phosphate buffer saline
,
PBS
)溶液(批号
AF29485475
)、胰酶(批号
J200014
)、青霉素链酶素双抗(批号
J190005
)购自美国
Hyclone
公司;
CCK8
试剂盒(批号
AR1199
)购自博士德生物工程有限公司;台盼兰(批号
20190520
)、线粒体膜电位检测试剂盒(批号
M8650
)、
Hoschst 33342
染色液(批号
C0031
)购自北京索莱宝科技有限公司;碘化丙啶(批号
B07T00102
)购自北京鼎国昌盛生物技术有限公司;
FITC Annexin V Apoptosis Detection Kit
(批号
9312842
)购自
BD Pharmingen
TM
;
β-actin
抗体(批号
10011066
)、
Caspase-3
抗体、
B
淋巴细胞瘤
-2
(
B cell lymphoma-2
,
Bcl-2
)抗体(批号
00080083
)、
Bcl-2
相关
X
蛋白(
Bcl-2 associated X protein
,
Bax
)抗体(批号
00080266
)、细胞色素
C
(
cytochrome C
,
Cyt C
)抗体(批号
00047881
)、
c-Jun
氨基末端激酶(
c-Jun
N
-terminal kinase
,
JNK
)抗体(批号
10010983
)、
p38
抗体(批号
00076414
)、细胞外调节蛋白激酶
1/2
(
extracellular regulated protein kinases1/2
,
ERK1/2
)抗体(批号
10009232
)、沉默信息调节因子
2
相关酶类
3
(
silent mating type informationregulation 2 homolog 3
,
Sirt3
)抗体(批号
00048945
)、辣根过氧化物酶标记的山羊抗小鼠抗体(批号
20000242
)、辣根过氧化物酶标记的山羊抗兔抗体(批号
20000217
)购自美国
Proteintech
公司;谷胱甘肽(
glutathione
,
GSH
)测定测试盒(批号
20200616
)、超氧化物歧化酶(
superoxide dismutase
,
SOD
)测定试剂盒(批号
20200617
)、乳酸脱氢酶(
lactate dehydrogenase
,
LDH
)测定试剂盒(批号
20200619
)购自南京建成生物有限公司;肌酸激酶同工酶
MB
(
creatine kinase isoenzymes-MB
,
CK-MB
)酶免试剂盒(批号
202006
)购自江苏酶免实业有限公司;
BCA
蛋白测定试剂盒(批号
080719191113
)、极超敏
ECL
化学发光试剂盒(批号
123119200922
)、苏木素
-
伊红(
HE
)染色试剂盒(批号
C0105S
)购自上海碧云天有限公司。
1.5
仪器
SpectraMax Paradigm
酶标仪(美谷分子仪器有限公司);
1645050
蛋白质电泳仪(美国
BIO-RAD
公司);
Forma™ 3 CO
2
恒温培养箱、
1300 series A2
生物安全柜、
Heraeus™ Megafuge™ 8
离心机、
iBright FL1000
多功能凝胶成像系统、
Countess™ II FL
全自动细胞成像系统(美国
Thermo Fisher Scientific
公司);
Cytoflex FCM
流式细胞仪(美国
Beckman
公司);
MK200-2
干湿恒温器(长春绿谷生物科技有限公司);
BX63
荧光显微镜(日本
Olympus
公司)。
2
方法
2.1
动物分组
、
造模与给药
按照文献方法
[13]
,将大鼠随机分为对照组、模型组及人参糖蛋白低、高剂量(
255
、
510 mg/kg
)组和卡托普利(
10 mg/kg
)组,每组
10
只。采用
ip
阿霉素法建立大鼠心肌损伤模型
[18]
,对照组
ip
氯化钠注射液(
1 mL/kg
),其余各组
ip
等体积阿霉素(
2.5 mg/kg
,阿霉素溶于生理盐水配制成质量浓度为
2.5 mg/mL
的溶液),
3
次
/
周,连续
2
周。人参糖蛋白、卡托普利分别溶于生理盐水配制成质量浓度为
150
、
10 mg/mL
的溶液。造模同时,对照组和模型组尾
iv
氯化钠注射液(
2.5 mL/kg
),各给药组尾
iv
相应药物,
1
次
/d
,连续
21 d
。
2.2
人参糖蛋白对心肌损伤大鼠血清生化指标及氧化应激指标的
影响
大鼠
ip
水合氯醛麻醉,腹主动脉取血,常温静置
30
~
60 min
,
4
℃、
5000 r/min
离心
5 min
,按照试剂盒说明书检测血清中生化指标(
LDH
、
CK-MB
)和氧化应激指标(
GSH
、
SOD
)。
2.3
人参糖蛋白对心肌损伤大鼠
心肌组织病理变化的影响
大鼠
iv
巴比妥(
150 mg/kg
)安乐死,取心肌组织,用
4%
多聚甲醛固定,石蜡包埋后切片(厚
5 μm
),脱蜡后置苏木素染液中染色
3 min
,
1%
盐酸乙醇分化
2 s
,自来水中返蓝
15 min
;再将切片放入伊红染液中继续染色
1 min
,用自来水冲洗残留的染液。将切片进行脱水和透明处理,中性树胶封片,于显微镜下观察。
2.4
细胞培养与分组
H9c2
细胞用含
10%
胎牛血清的
DMEM
培养基,于
37
℃、
5% CO
2
、
饱和湿度的培养箱中培养。设置对照组、模型组和不同质量浓度(
50
、
100
、
200 μg/mL
)人参糖蛋白给药组
[12]
。模型组和各给药组加入
0.58 μg/mL
阿霉素
[19]
,各给药组另加入相应药物,对照组加入不含药物的培养基,培养
24 h
。
2.5
人参糖蛋白对细胞活力的影响
取对数生长期的
H9c2
细胞,以
1
×
10
4
/
孔接种于
96
孔板中,培养
24 h
,按
“
2.4
”
项下方法处理。每孔中加入
10μL CCK-8
溶液,孵育
1
~
4 h
,于
450 nm
处测定吸光度(
A
)值,计算细胞存活率。
2.6
人参糖蛋白对细胞周期和细胞凋亡
的影响
取对数生长期的
H9c2
细胞,以
2
×
10
5
/
孔接种于
6
孔板,培养
24 h
后,按
“
2.4
”
项下方法处理。
收集细胞悬液,加入
70%
乙醇
4
℃固定过夜,用
PBS
洗涤
3
次,加入
1 mL
碘化丙啶(
PI
)染料,混匀后避光孵育
30 min
,流式细胞仪进样检测,用
ModFit
软件对细胞周期进行分析。
收集细胞悬液,加入
200μL
结合缓冲液、
5 μL
膜联蛋白
V
和
5 μL PI
,室温避光孵育
15 min
,流式细胞仪进样检测细胞凋亡情况。
2.7
人参糖蛋白对细胞内
ROS
水平的影响
取对数生长期的
H9c2
细胞,以
2
×
10
5
/
孔接种于
6
孔板中,培养
24 h
,按
“
2.4
”
项下方法处理。收集细胞悬液,加入
100 μL DCFH-DA
探针(
10 μmol/L
),孵育
20 min
,用无血清的
DMED
培养基清洗
3
次,流式细胞仪进样检测。
2.8
人参糖蛋白对细胞线粒体膜电位
的影响
取对数生长期的
H9c2
细胞,以
2
×
10
5
/
孔接种于
6
孔板中,培养
24 h
,按
“
2.4
”
项下方法处理。收集细胞悬液,加入
0.5 mL JC-1
染色工作液,孵育
20 min
,
4
℃、
1400 r/min
离心
3 min
,弃上清,用
JC-1
染色缓冲液洗涤
2
次,用
JC-1
染色缓冲液重悬细胞,流式细胞仪进样检测。
2.9
人参糖蛋白对细胞凋亡相关蛋白
表达的影响
取对数生长期的
H9c2
细胞,以
2
×
10
5
/
孔接种于
6
孔板中,培养
24 h
,按
“
2.4
”
项下方法处理。
3000 r/min
离心
5 min
,弃上清,加入
RAPI
裂解液,裂解
4 h
;
12 000 r/min
离心
30 min
,吸取上清液,采用
BCA
蛋白定量试剂盒测定蛋白质量浓度,加入上样缓冲液,
95
℃金属浴
10 min
。蛋白样品经十二烷基硫酸钠
-
聚丙烯酰胺凝胶电泳,转至
PVDF
膜,加入
5%
脱脂牛奶封闭
1.5 h
,分别加入
β-actin
(
1
∶
5000
)、
Bax
(
1
∶
2000
)、
Bcl-2
(
1
∶
1000
)、
Caspase-3
(
1
∶
1000
)、
Cyt C
(
1
∶
1000
)、
JNK
(
1
∶
3000
)、
p38
(
1
∶
500
)、
ERK1/2
(
1
∶
2000
)、
Sirt3
(
1
∶
1000
)抗体,
4
℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔
/
鼠抗体,孵育
1.5 h
,滴加
ECL
化学发光液,采用多功能凝胶成像仪显影。
2.10
统计学分析
采用
GraphPad Prism7
软件进行统计学分析,数据以
表示,多组间比较采用单因素方差分析,组间两两比较采用
Tukey’s
检验。
3
结果
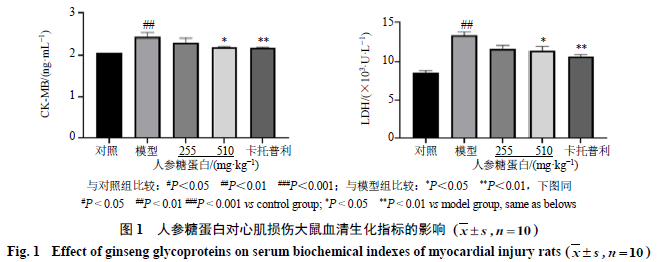
3.1
人参糖蛋白对
心肌损伤大鼠血清生化指标的影响
如图
1
所示,与对照组比较,模型组大鼠血清中
CK-MB
和
LDH
活性均显著升高(
P
<
0.01
),表明造模成功;与模型组比较,人参糖蛋白高剂量组
和卡托普利组
CK-MB
和
LDH
活性均显著下降(
P
<
0.05
、
0.01
)
,表明人参糖蛋白可以减轻阿霉素诱导的大鼠心脏毒性。
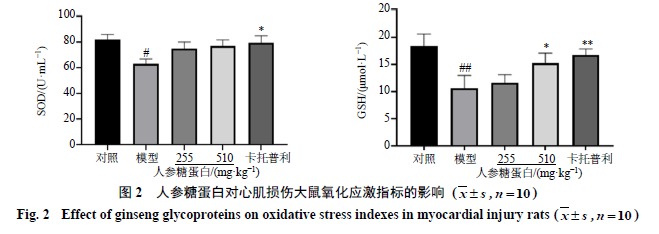
3.2
人参糖蛋白对心肌损伤大鼠氧化应激指标的影响
如图
2
所示,与对照组比较,模型组大鼠血清中
SOD
活性和
GSH
水平均显著降低(
P
<
0.05
、
0.01
);与模型组比较,人参糖蛋白高剂量组
GSH
水平显著升高(
P
<
0.05
),
SOD
活性呈升高趋势。
3.3
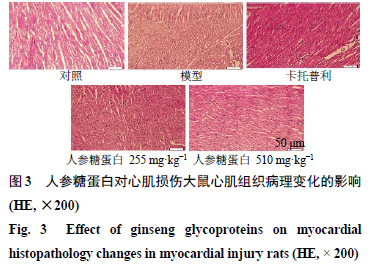
人参糖蛋白对大鼠心肌组织病理学的影响
如图
3
所示,对照组心肌细胞结构完整,心肌肌束排列整齐,无明显组织病理学损伤;模型组心肌细胞严重损伤,心肌肌束排列明显紊乱,产生炎性细胞浸润和核溶解;与模型组比较,人参糖蛋白低剂量组没有明显变化,人参糖蛋白高剂量组和卡托普利组对阿霉素所致的心肌组织病理学损伤有明显改善作用。