抗体-药物偶联剂(Antibody-drug conjugates, ADC),一种将化合物类药物通过连接物(linker)与抗体偶联形成的药物,进而降低化疗中常见的药物非特异性的全身毒性,成为肿瘤治疗用单抗的研究与发展热点。
ADCs经过血液运输到达并识别有表面抗原的癌细胞,ADCs的抗体部分与抗原结合以后被内吞进入癌细胞内部并进一步在溶酶体中被剪切,释放有杀伤作用(作用于DNA或细胞微管)的化合物类药物。吸收ADC药物的细胞死亡裂解后,毒素分子会释放至附近的其他肿瘤细胞进一步发挥杀伤作用。ADCs药物的研发包括:合适的药物靶点、高度特异性的抗体、理想的偶联子、高效的药物。
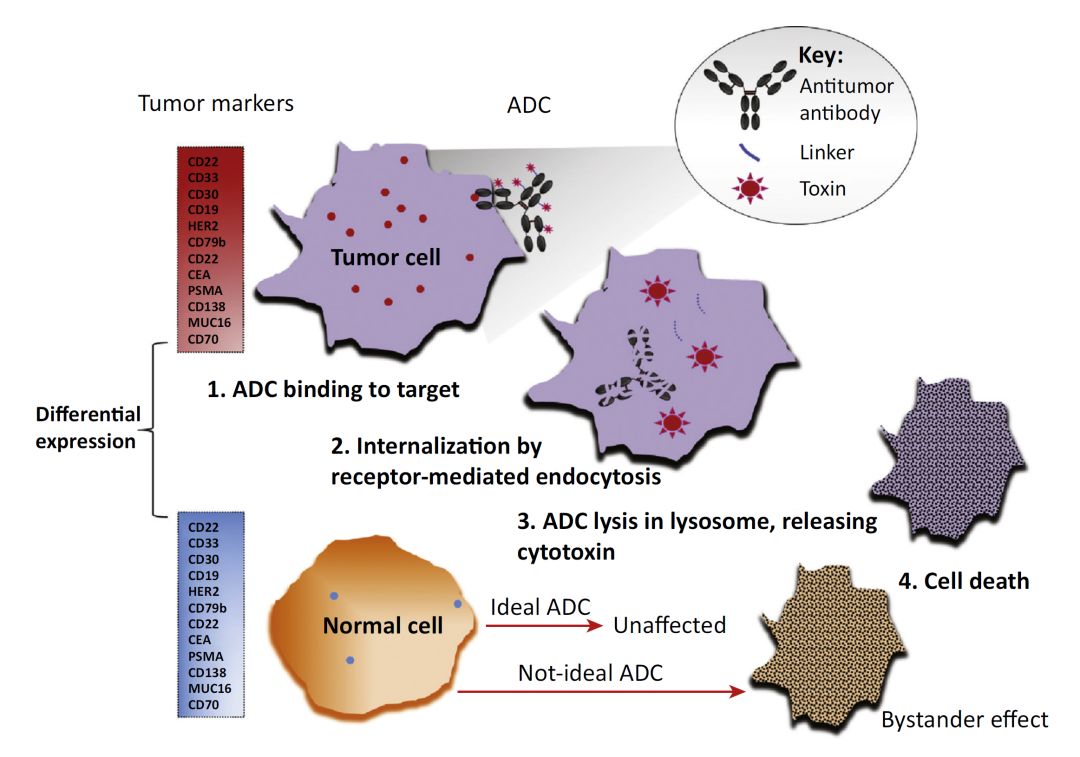
抗体偶联药物的机理
ADC作为发展最快的癌症治疗药物之一,结合了抗体识别目标的特异性以及偶联药物针对癌细胞的细胞毒性,在癌症治疗等领域成果初现。
目前已经有四款抗体偶联药物在美国上市,同时还有60种以上ADC药物在临床试验的各个阶段。偶联了抗体的药物(cytotoxic warheads),对照未偶联抗体的药物,在多种癌症模型中被证明更加有效。
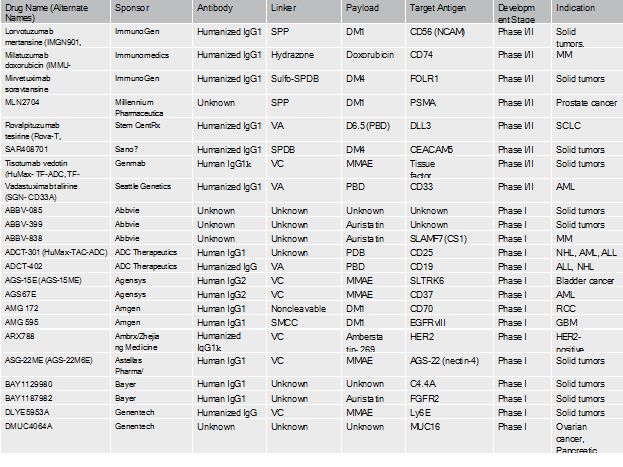
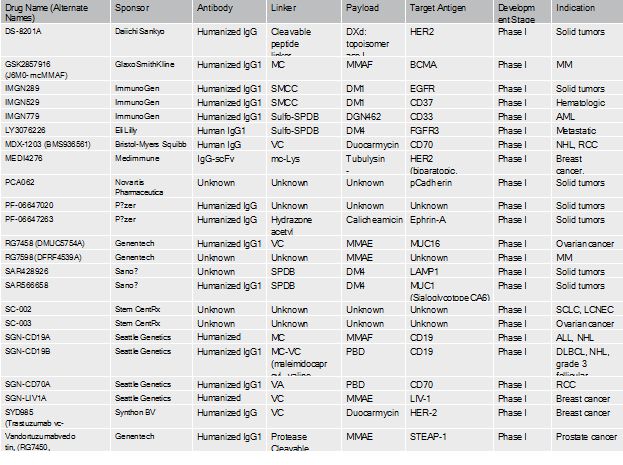
ADC药物研发管线(截止到2016年底)
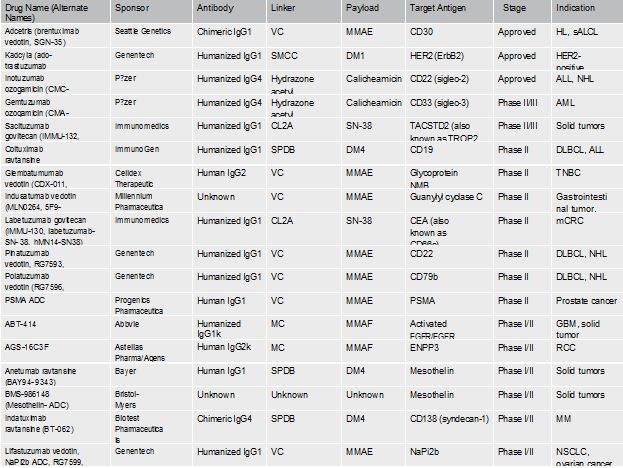
最早上市的辉瑞的Mylotarg在2004启动的上市后验证性III期研究(SWOG106)中发现,治疗组有严重的致命性肝损伤,且未表现出明显的生存获益。2010年6月辉瑞主动将Mylotarg撤市。之后辉瑞开展了4项总计3060例急性髓细胞白血病关于Mylotarg的临床试验,包括ALFA-0701证明了其联合化疗对新确诊CD33+成人AML的疗效和安全性。同时另外2项Mylotarg单独用药的临床研究中也证明了其安全性和疗效。2017年9月1日,依照专家咨询委员会6:1的投票结果,FDA再度批准Mylotarg上市,用于治疗新确诊的CD33+成人急性髓性白血病(AML),以及对初始治疗无应答的2岁以上儿童的难治性CD33+AML。
作为ADC行业的领头羊企业,Seattle Genetics的Adcetris于2011年第二个获批上市,用来治疗霍金淋巴瘤和系统性间变性大细胞淋巴瘤。罗氏的Kadcyla是第三个上市ADC,它是基于其王牌药物Trastuzumab与emtansine通过赖氨酸偶联设计而成用来治疗HER2阳性的接受过化疗和赫赛汀疗法的乳腺癌患者。2017年8月,Pfizer的第二个ADC药物Besponsa获批用来治疗成人复发性及难治性前体B细胞淋巴细胞白血病。
总体上来说,抗体技术的进步使得研发和制造针对特定靶点的高亲和度的人源抗体成为可能。
抗体(Ab)选择性地与肿瘤相关抗原(tumorassociated antigen)结合,从而使偶联的药物(cytotoxic warhead)只作用于目标细胞,而更少的作用于正常细胞,从而减少治疗的副作用,并增加药物浓度的承受性。在二十一世纪第一个十年开发的第一代ADC技术商业化,应用于临床治疗,并取得有限成功的同时,第二代ADC技术孕育而生。相比于第一代ADC,第二代拥有更高的cytotoxic drug conjugation, 更少的的naked抗体, 并且抗体和药物之间的链接更加稳定。目前,第三代ADC的开发正在进行中。下图给出了第一,二,三代ADC研发的一些例子。
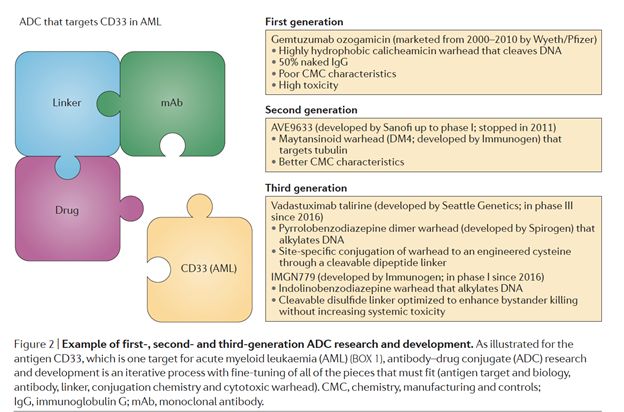
曲折中前行的ADC药物
作为抗体-小分子药物偶联剂,ADC药物与单纯直接使用抗体+化药的联用治疗方法相比,可以显著性提高肿瘤患者生存期。ADC药物本身是很好的概念,但其技术转化上仍期待更大突破。抗体作为导弹的靶向性和小分子作为毒性分子的弹头,两个关键点已经齐备,但抗体需要有效内化、linker需要高效的释放同时在胞外保持稳定性,这其中仍有诸多难点,导致小分子进入靶细胞内并起效的比例微乎其微,带来很大有效性与安全性的潜在问题,与ADC研发的大好前景相伴的是一系列的挑战。
第一,新开发的ADC所针对的疾病分子机理了解不足
。
这一点对于较为罕见的肿瘤来说尤其普遍。在研发过程中,合适的动物模型比较欠缺. 并且合适的,能很好的模仿动物模型机理的体外模型也较为欠缺。这个过程中的挑战在于,给药途径(route of administration), 药物配方(product formulation) 以及细胞表面相互作用必须被充分考虑,以确保安全性。
第二,接受ADC疗法的病人并不是都对ADC有着充分的反应
,而且,虽然ADC的一大优势是其特异性,但off-targettoxicity还是一定程度存在,这些毒性在一定程度上限制着ADC的最大给药剂量。所以,新开发的ADC投入临床的挑战在于提高拥有靶向肿瘤抗原表达的病人中的有效性,并且抑制脱靶毒性(off-targets toxicity),使得毒性要显著低于cytotoxicpayload单独使用时的毒性。
第三,目前作为cytotoxic warhead的选择不多
。目前大约三分之二在临床试验阶段的ADC的cytotoxic warhead只是antimitotic agents的两类:Auristatin和Maytansinoid. 这充分反映了寻找合适的cytotoxic warhead的难度。选找合适的warhead挑战在于,warhead要有足够高的有效性(potency), 相对合适的亲水性(hydrophilicity), 拥有合适的化学结构从而能连接到抗体,以及对于Multidrug Resistance Protein 1(MDR1)-mediated efflux的容忍度。后者是ADC drug resistance的常见原因。基于methotrexate, doxorubicin 和 vinca alkaloid的癌症治疗ADC在临床试验上的失败就是有效性(potency)未达标的例子。
第四,cytotoxic warhead和抗体间的linker的优化也是挑战之一。
当ADC在病人的血液系统中流通时,linker必须要稳定,以防止off-target毒性。但当ADC到达目标肿瘤细胞时,warheads又要方便被释放。一些药代动力学和代谢研究指出,目前第二代ADC在血液中的稳定性还不够高。比如,目前大部分第二代ADC的linker是maleimide-type,这种类型的linker在体液中较容易de-conjugate,从而导致off-target毒性。因此,在第三代ADC的开发中,找到更稳定而有灵活的linker是值得关注的一大挑战。
正如一枚硬币有两面,以上所提到的诸多挑战同时也是改善ADC药物的重大机遇。因此,在本届华人抗体协会年会上,
现任齐鲁医药首席医学官、
前Ambrx Inc.的首席医学官(CMO)黑永疆博士将带来“Challenges inthe clinical development of antibody-drug conjugates (ADCs)”的演讲。
同时黑博士在制药和生物技术领域拥有将近 20 年的经验,Ambrx、安进、罗氏和诺华等多个公司参与临床开发工作,领导了美国、日本、欧洲、中东和非洲以及中国等多个地域的药物临床试验研究,届时欢迎您参加年会与黑永疆博士探讨交流抗体药物临床试验方面的问题。
参考文献
1. Beck, A., Goetsch, L., Dumontet, C., & Corvaïa, N.(2017). Strategies and challenges for the next generation of antibody–drug conjugates. Nature Reviews Drug Discovery, 16(5), 315-337.
2. B.Vijayalakshm
, A
.,
Sushrut, A.
,& Richard, O.(2016).Coming-of-Age of Antibodies in Cancer Therapeutics.
Trends in Pharmacological Sciences
, 37(12), 1009-1028.
3. Gébleux,R., & Casi, G. (2016). Antibody-drug conjugates: Current status and future perspectives.
Pharmacology &Therapeutics,167
,48-59.

Dr. Hei is the Chief Medical Officer (CMO) at Qilu Parmaceuticals. Before that,
Dr. Hei is the CMO of
Ambrx responsible for the clinical development strategy and clinical operations to support commercialization of Ambrx’s pipeline including antibody-drug conjugates (ADCs) and CD3-based biospecifics. Prior to Ambrx, Dr. Hei worked at Amgen for more than 9 yearsas the Executive Medical Director in oncology global development and medical affairs in the capacity of global development leaders for several oncologypipeline molecules and marketed products including small molecules suchas motesanib as well as biologics such as conatumumab and Vectibix. Additionally, during his tenure at Amgen,Dr. Hei was assigned the role of the medical head in China where he built the clinical medical teams and established product development and clinical operations capabilities for Amgen China. Before Amgen, Dr. Hei worked forRoche Laboratories, Inc., and Novartis oncology as the US Medical Director for Roche, and Senior Global Brand Medical Director/Executive Director for Novartis Oncology where he led the development and execution of medical plans and expanded the investigator-initiated clinical research. In addition, Dr.Hei supported regulatory filings and submissions at the FDA, PMDA (Japan) EMA,and the Chinese FDA (cFDA). Dr. Hei received his medical degree from Shihezi Medical College in China, and graduate degrees from the West China University of Medical Sciences (M.Sc) and the University of British Columbia in Canada (Ph.D.).
欢迎参加华人抗体协会第二届年会
如果您想聆听全球行业一线领军人物针对抗体药各领域的精彩分享;














