近年来,无论是作为研究对象还是在液体活检中监控癌症的发展,循环肿瘤DNA(ctDNA)的潜在应用范围随着基因组学和分子生物学技术的发展得到了极大地扩展。研究证明ctDNA在癌症的早期筛查、诊断、治疗策略的制定以及预后监测等全周期健康管理中表现出了巨大潜力。本文就ctDNA在癌症周期的监控以及在临床上的应用展开了论述。
一、cfDNA的发现历史
1948年,Mandel和Métais发现人血液中无细胞核酸片段。随后几十年间研究人员陆续研究了无细胞DNA(cfDNA)的起源和特征。在健康人群中,血浆中的cfDNA浓度往往介于1~10 ng/ml之间。1977年首例报告了患有癌症的血清中的cfDNA水平,同时在其他生理条件或病理情况下,如急性创伤,脑梗死,运动,移植和感染,血浆中cfDNA浓度也会相应的提高。直至1989年,Stroun及其同事们报道说,癌症患者血浆中有一些cfDNA来源于癌细胞。因此,cfDNA中的突变是癌症的高度特异性标记,由此得到循环肿瘤DNA(ctDNA)的概念。另外,1997年,Lo等鉴定了母体血浆中的胎儿DNA,推动了产前医学对于cfDNA的临床使用,包括性别测定,单基因疾病的鉴定和非整倍体无创产前诊断(NIPT),对唐氏综合征(21三体)的诊断等。
二、cfDNA的生物学起源
cfDNA被认为主要通过细胞分泌、凋亡和坏死从细胞释放出来的。除了在血液之外,研究人员在各种体液中检测到了cfDNA,包括尿液,脑脊液,胸膜液和唾液。同时,已有研究表明循环中cfDNA的半衰期为16分钟至2.5小时,这是ctDNA可以被应用于对癌症病人治疗效果临床实时监测的理论基础。cfDNA通过核酸酶作用从循环中清除,通过肾脏排泄到尿液中,同时肝脏和脾脏对cfDNA摄取,随后由巨噬细胞降解。 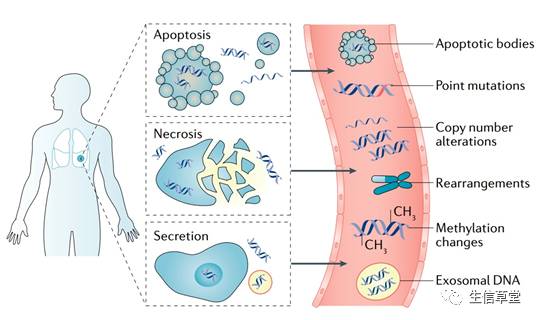
图1 cfDNA中变异的起源:细胞通过凋亡,坏死和分泌的组合释放cfDNA
三、ctDNA分析平台
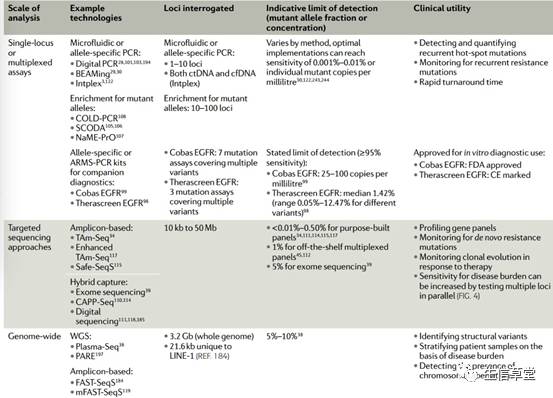
由于ctDNA在cfDNA中所占的比例极为微小(<0.1%),将其应用在临床检测上是对痕量核酸检测技术的一个巨大挑战。目前具备极微量核酸基因突变检测能力的技术主要包括ARMS技术、数字PCR技术以及第二代测序(NGS)。
ARMS技术是被中国CFDA批准用于临床的血液检测方法,该技术具有操作简单,特异性好等特点,但是敏感性不如数字PCR,可检测的基因数量较少且只能检测已知位点。而数字PCR技术,具有极高的敏感性,可绝对定量;但该方法检测通量较低,且不能检测融合变异。
NGS技术可检测未知突变且检测基因数量不受限,虽然有一些亟待解决的问题,如在检测灵敏度方面虽不及数字PCR技术、稳定性上有所欠缺,但随着与肿瘤相关的基因位点不断增多,该方法能够同时在靶向测序以及更大范围的全基因组水平上对ctDNA进行监测,从而指导临床医师对肿瘤耐药突变的监测与研究,因此该方法具有很大的应用潜力。
表1 ctDNA分析技术平台的比较与应用
四、ctDNA在癌症治疗过程中的应用
随着核酸检测相关技术的迅猛发展, ctDNA已经被逐步应用于临床转化中,如在癌症的早期筛查、诊断、指导用药和预后监测。
1.癌症的早期筛查:在通过影像学手段未能发现病灶时对被检测者进行早期筛查,判断肿瘤原发灶;对于显现出症状的患者,通过ctDNA基因分型技术对患者的特异性的癌症进行检测,可以加快准确诊断、治疗。
2.治疗选择:目前,对于癌症患者,特别是具有快速疾病进程的患者通常采用的药物治疗手段是靶向药物,这就需要对患者的相应基因上的位点进行分型,传统的方法是采用肿瘤组织的DNA进行基因分型,但在临床应用过程中,无法获得足够的肿瘤组织或者无法获得经过治疗后的肿瘤组织,ctDNA极好的解决了这一问题。
3.实时监控:如前所述,ctDNA检测作为一种实时的无创的检测方法,能够真实的反映实体瘤组织中的基因突变图谱与频率,将有助于临床医师及时的了解患者的治疗后疾病进展情况。
4.最小残留病灶以及复发风险的预后评估:在治疗前或治疗后,通过监测患者体内ctDNA,对其体内的实体瘤相关基因进行监测,将有助于临床医师对进展风险进行相应的评估,对复发风险高的患者采取更多的辅助治疗手段,而对低风险患者可以有效地避免过度治疗。
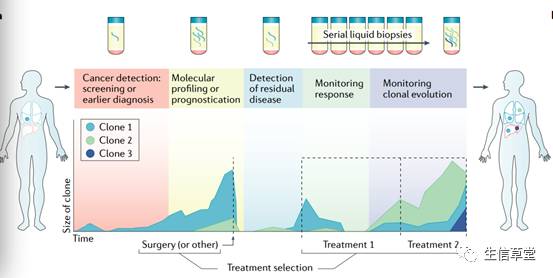
图3 ctDNA在癌症治疗过程中的应用
参考文献:
Wan J C M, Massie C, Garciacorbacho J, et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA[J]. Nature Reviews Cancer, 2017, 17(4):223.







