【兴证医药:徐佳熹/孙媛媛/赵垒/杜向阳/张佳博/黄翰漾/向秋静/缪知邑】
投资要点
近日,为响应10月1日中央办办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(下文简称《创新意见》),保障有关改革措施落实于法有据,食品药品监管总局发布《〈中华人民共和国药品管理法〉修正案(草案征求意见稿)》与《药品注册管理办法(修订稿)》,公开征求意见。
投资建议: 本次《〈中华人民共和国药品管理法〉修正案(草案征求意见稿)》,以及《药品注册管理办法(修订稿)》均为响应《创新意见》要求的及时修订内容,其核心在于配合《创新意见》顺利实施而对原有冲突或缺失部分进行修订完善。从具体修订内容来看,全面落实药品上市许可持有人制度,为创新药研发机构提供轻资产的选择可能性,鼓励创新药研发端;取消临床试验基地的GLP认证制度,采取备案制度,以开源方式增加新药临床试验产能,缓解现阶段临床试验产能短缺;规定新药临床申请试验申请60天时限,分类管理加快创新药上市审评、现场检查的进度,破除限速步骤加快新药研发进程。本次药品管理法修正案草案和注册管理办法修订稿针对国内创新药研发端激励不足、临床试验产能受限、临床和上市申报审批时间过长等多方面困境,为创新药提供了诸多实际的利好。另一个角度来看,随着分类管理逐步推行,国内创新药的标准将会提高,过去创新层次较低的Me-Too甚至Me-Worse药将受到冲击,而真正有能力做到全球性创新级别的企业将集中享受政策红利。随着创新药政策环境逐步与欧美接轨,A股、H股资金来源的国际化和创新药标的的日益增加,未来创新药估值体系将有望实现从PEG向Pipeline转变,2018年具有大品种pipeline的企业将会获得估值溢价,推荐关注恒瑞医药、康弘药业、复星医药、贝达药业、石药集团等。
风险提示:征求意见政策落实风险、创新药标准提升下创新层次低的药企承压
报告正文
事件
点评
响应《创新意见》要求,部分条款进行修改。本次药品管理法修正案草案征求意见稿是从《创新意见》出发的部分条款修正案,响应《创新意见》中第三十四条要求(“改革措施涉及法律修改或需要取得相应授权的,按程序提请修改法律或由立法机关授权后实施”),对现行《药品管理法》进行局部修改,目的是为确保《创新意见》相关改革措施尽快实施,是落实《创新意见》的重要环节。《药品管理法》全面修订仍在进行之中,预计未来还将列入《创新意见》中专利链接、专利期补偿等探索和试点工作。本次修正案草案征求意见稿相比于现行《药品管理法》版本增加6条,修改9条,删去2条。主要修改内容包括:
总结试点经验,全面落实药品上市许可持有人制度。为配合《创新意见》相关内容,草案征求意见稿总结了药品上市许可持有人制度试点经验,将药品上市许可持有人制度全方位整合入其中,全面落实药品上市许可持有人制度。药品上市许可持有人制度有助于创新药产业分工协作,令创新药研发端免于承担临床、生产等环节的重资产压力。

从严进宽出到宽进严出:取消GCP、GMP、GSP认证审批制度,增加建立职业化药品检查员制度强化后续跟踪检查。为落实国务院“放管服”要求,此次修正案草案对临床试验、生产、销售等资质审查的总体思路发生明确转变,借鉴海外成熟经验,从严进宽出到宽进严出,大大缩短临床基地、生产、销售资质获得时间和成本,同时加大日产监管力度,赋予检查人员更高的要求和切实的职能,加强常规检查人员职业分化,预计未来各式飞行检查将呈现日益频繁的趋势。值得注意的是,本次修正法草案只是取消了GLP、GMP、GSP认证制度而并非取消GLP、GMP、GSP,临床基地、生产企业、销售企业依然需要遵守GLP、GMP、GSP内容要求,GLP、GMP、GSP依然是临床基地、生产企业、销售企业不变的行为准则。

新药临床申请受理时限60日,破除限速步骤加快新药研发进程。此次修正案草案第二十九条提出,“国务院药品监督管理部门应当自受理新药临床试验申请之日起六十个工作日内决定是否同意开展临床试验;逾期未通知的,申请人可以开展临床试验”。其明确了药监部门对于新药临床试验申请受理的时限为六十个工作日,过期未给出否定或质疑的意见则默认为同意。此前国内新药申请大量堆积,尽管药监部门已重点加速进行审评工作,并出台优先审评政策,但由于过往积压存量巨大,新药临床申请仍处于排队状态。此次修正案草案接轨国际的60天无反馈后默认通过制度,将极大的加快新药临床试验申请获批速度,有效地缩短创新药研发时间。同时,药品注册管理办法(修订稿)对新药的上市审评、现场检查等诸多环节也给予相较非创新药更短的时限,未来创新药有望大大缩短研发阶段时间,早日上市。
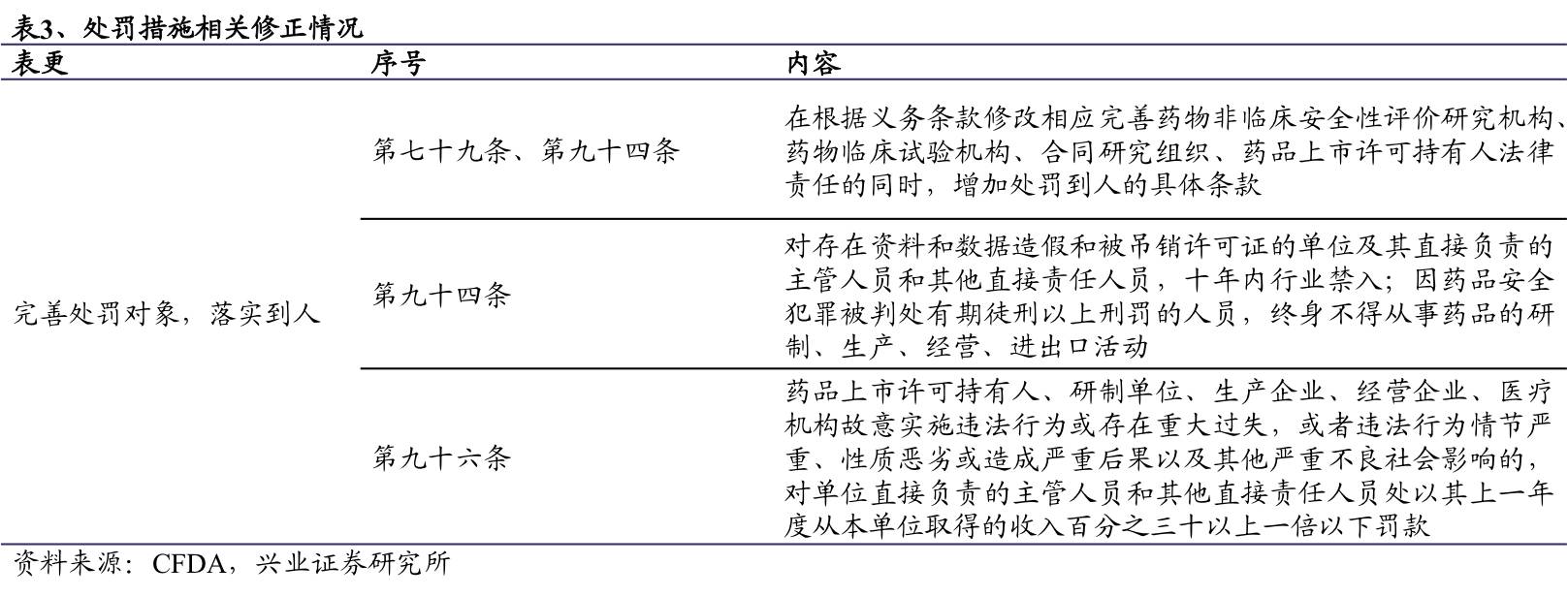
处罚更加严明具体,落实处罚到人要求。本次修正案草案在有法可依的基础上明确并强化了各式违法行为的具体处罚对象和措施,未来执行将更加清晰。
投资要点: 本次《〈中华人民共和国药品管理法〉修正案(草案征求意见稿)》,以及《药品注册管理办法(修订稿)》均为响应《创新意见》要求的及时修订内容,其核心在于配合《创新意见》顺利实施而对原有冲突或缺失部分进行修订完善。从具体修订内容来看,全面落实药品上市许可持有人制度,为创新药研发机构提供轻资产的选择可能性,鼓励创新药研发端;取消临床试验基地的GLP认证制度,采取备案制度,以开源方式增加新药临床试验产能,缓解现阶段临床试验产能短缺;规定新药临床申请试验申请60天时限,分类管理加快创新药上市审评、现场检查的进度,破除限速步骤加快新药研发进程。本次药品管理法修正案草案和注册管理办法修订稿针对国内创新药研发端激励不足、临床试验产能受限、临床和上市申报审批时间过长等多方面困境,为创新药提供了诸多实际的利好。另一个角度来看,随着分类管理逐步推行,国内创新药的标准将会提高,过去创新层次较低的Me-Too甚至Me-Worse药将受到冲击,而真正有能力做到全球性创新级别的企业将集中享受政策红利。随着创新药政策环境逐步与欧美接轨,A股、H股资金来源的国际化和创新药标的的日益增加,未来创新药估值体系将有望实现从PEG向Pipeline转变,2018年具有大品种pipeline的企业将会获得估值溢价,推荐关注恒瑞医药、康弘药业、复星医药、贝达药业、石药集团等。
风险提示:征求意见政策落实风险、创新药标准提升下创新层次低的药企承压















