肿瘤的恶性进展很大程度上受肿瘤细胞和间质之间动态互动的影响。外泌体内容物可靶向运输给目标细胞和组织,在细胞交流中起重要作用。肿瘤来源的miRs在肿瘤微环境中与间质细胞相互作用,调节肿瘤进展,血管形成,转移以及免疫逃避。细胞代谢方式的转变是肿瘤的特征之一。多种不同类型的肿瘤通过触发相应机制,依赖线粒体对底物进行最优的氧化磷酸化,更好地满足其能量需求。外源性外泌体通过诱导代谢重编程修复肿瘤细胞呼吸作用,抑制肿瘤生长。这些与肿瘤相关的外泌体miRs可能在诊断与治疗肿瘤的过程中发挥价值。
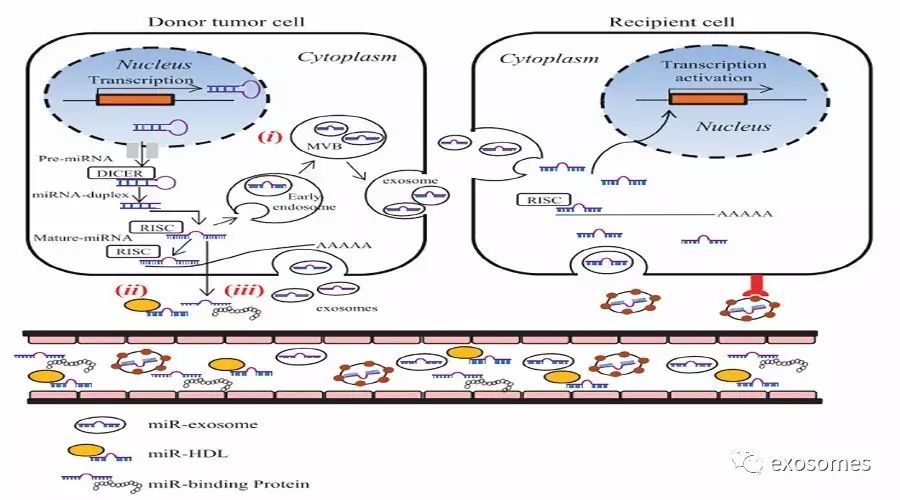
一、外泌体源性miR 在调节肿瘤微环境代谢中的作用
在生理、病理过程中,外泌体起着多分子信使的作用。多个研究证实,胶质母细胞瘤、肺细胞、内皮细胞和间充质细胞存在经外泌体的miR水平转移现象。比如,肺肿瘤来源的外泌体含丰富的mRNA、miR 和促炎症蛋白。这些分子的水平转移,能刺激肿瘤细胞增殖,使肿瘤生长过程更具炎症表型。
近来研究显示,miR-126通过靶向胰岛素受体底物-1(IRS1),控制肿瘤转移,调节血管形成。IRS1作为衔接蛋白,除了在代谢与促生长方面的功能外,在肿瘤恶性转变过程中也发挥作用。
MiR-126在内皮细胞(ECs)中高表达,并可以分泌到肿瘤周围环境中。ECs释放的外泌体富含miR-126,被周围ECs摄取(旁分泌),或者转移至他处调节下游细胞内信号介质。值得注意的是,高浓度葡萄糖治疗或糖尿病会使外周血单核细胞内miR-126水平下降,这与促血管生成功能损伤有关。另一方面,氧化应激及葡萄糖缺乏会促进更多miR-126 装载入外泌体。在胃癌组织中,miR-126下调与微血管密度和VEGF-A表达成负相关。此外,miR-126还参与葡萄糖稳态。异位表达的miR-126减弱Akt信号,抑制胞质内FoxO1聚积,使其进入细胞核内,促进参与糖异生、抗氧化应激等基因的表达,这在恶性间皮瘤小鼠身上获得证明。细胞高表达miR-126时,受FoxO1调节的SOD2和CAT水平均明显升高,通过增加抗氧化物质的合成,减轻线粒体氧化应激,达到减轻肿瘤严重性,减小肿瘤负荷的效果。这些研究将miR-126和抑制肿瘤的发生与进展联系起来。
当然,肿瘤细胞也会反击回去。肿瘤通过释放富含miR-122的肿瘤源性外泌体,被周围正常细胞摄取后,影响正常细胞M2型丙酮激酶活性,抑制细胞糖酵解代谢,使得肿瘤细胞能够夺取更多葡萄糖来壮大自己。而对正常细胞来源的miR-122刺激,肿瘤细胞会向周围释放出胰岛素样生长因子1(IGF1),抑制正常细胞内miR-122的合成。
乳腺癌患者血浆中发现的miRs有很多种。对应的研究指出,乳腺癌外泌体中高水平的miR-373可能与三阴性乳腺癌相关(雌激素受体ER、孕激素受体PR和原癌基因Her-2均为阴性),显示血浆外泌体miR-373作为侵袭性肿瘤生物标志物的可能性。探究外泌体源性miRs和不同肿瘤转移的关系可以为我们提供新的诊断手段来评估肿瘤分期,并监视其进展。乳腺癌血浆中外泌体内高水平的miR-105预示肿瘤将会发生转移。类似的,在乳腺癌和黑色素瘤脑转移来源的外泌体中,miR-210发生上调,miR-19a和miR-29c则下调。
初步研究结果显示,血管源性miR-126高表达于正常血管组织,但是在早期非小细胞肺癌(NSCLC)中,miR-126的含量要多于正常肺组织和进展期NSCLC。早期NSCLC中的这种外泌体内的miR-126可以水平转移给内皮细胞,调节肿瘤转移和血管生成。而进展期NSCLC外泌体miR-126含量低,结果导致血管重塑及内皮细胞成熟的缺陷。上述资料证明,用外泌体中的miR-126比用全血中的mR-126来评估NSCLC更好。此外,另外一些miRs,如 miR-221/222在肿瘤耐药中发挥作用,外泌体源性miR-24-3p则参与鼻咽癌发病机制,并可以作为鼻咽癌预后生物标志物。
外泌体源性miRs可以改变受体肿瘤细胞或者间质细胞的生物学行为,包括进展和转移。另一方面,肿瘤释放的外泌体通过改变某些信号通路,达到限制肿瘤抑制物表达、促进肿瘤形成的作用。因此,针对这些外泌体的生成和组装,是一种重要的治疗策略。
策略一、抑制肿瘤产生外泌体
骨髓源的抑制性细胞接受肿瘤源性外泌体后激活抑制性T细胞,这是肿瘤逃避免疫系统攻击的方式之一。阿米洛利通过减少外泌体产生,可以延缓肿瘤进展。