早期乳腺癌
148O-来自III期临床研究GEICAM/2006-10研究结果:辅助氟维司群(F)+阿那曲唑(A)治疗绝经后HR+HER2-早期乳腺癌(EBC)
本研究旨在通过对比A和A+F探讨雌激素完全阻断是否能避免辅助AI治疗耐药。
绝经后+HER2-EBC患者按1:1随机接受5年A或A+F(A+F250mg/4周同时联用3年序贯2年A)。患者根据既往是否化疗、淋巴结阳性个数(1/1-3/≥4)、HR状态(ER+PR+或ER+PR-或ER-PR+)及肿瘤部位分层。主要目标是DFS。若预期达到5年DFS绝对增长3%(90%A,93%A+F)要求可评估样本量为2716。
2008年1月-2010年6月期间,分别有437名患者入组A组,435名患者入组A+F组。组间基线基本平衡。中位年龄62岁,N0占46.9%,ER+PR+89.5%,无化疗史68.2%。A和F的中位相对剂量密度分别为99%和81%。A组和A+F组最相关的2-3级毒性反应(>5%)包括高血压(13.2%和9.9%)、疲乏(5.2%和11.8%)、LDL胆固醇水平升高(9.4%和5.3%)、骨质疏松(5.5%和6.9%)、骨骼肌肉/关节痛(26.3%和29.4%)。中位随访时间6.3年后,总的5年DFS为90.99%(A90.77%,A+F91.25%,P=0.357)。9.4%患者出现BC复发(A10.5%,A+F8.3%),4.3%患者出现第二肿瘤(A2.9%,A+F4.6%)。结果未达到预期生存率及乳腺癌特异生存率。
GEICAM/2006-10试验不能证实辅助A+F相对于A单药带来更大的无病生存获益。
149O-辅助曲妥珠单抗(T)序贯来那替尼治疗早期HER2+乳腺癌:来自ExteNET试验5年随访结果
HERA试验中,24%患者接受1年辅助曲妥珠单抗治疗后在第11年随访时出现复发。ExteNET试验2年随访结果显示辅助T后,1年来那替尼与安慰剂相比,能显著改善HER2+早期乳腺癌患者的iDFS(HR0.67,95%CI0.50-0.91,p=0.0091)【Chan et al. Lancet Oncol 2016】。此次是5年随访结果发布。
ExteNet是一项国际多中心随机双盲安慰剂对照的III期临床试验。患者随机接受口服来那替尼240mg/d或安慰剂1年。计划通过意向治疗(ITT)分析评估5年随访数据。
ITT人群包括2840名患者(来那替尼n=1420;安慰剂n=1420)。52名患者在头两年随访中死亡。更新数据如下表。次要疗效终点指标与早期分析结果相符。
辅助T治疗后序贯1年来那替尼可显著改善HER2+EBC患者的5年IDFS,疗效持续。根据不同治疗方案分层分析显示HR+HER2+患者获益更大。OS数据尚待公布。
150O-PR LN-(pT1abN0)小肿瘤并非千篇一律:EORTC10041/BIG 3-04(MINDACT)试验亚组分析结果
pT1abN0乳腺癌总体复发风险低因此相关辅助系统治疗一直存在争议。识别辅助治疗获益亚组的最佳工具目前仍空缺。
MINDACT试验中pT1abN0患者均接受了基因G(MammaPrint
®
)和临床C(Adjuvant!修改版)复发风险评估。G&C均低风险者则免去化疗(CT),G&C均高风险者建议CT。G&C不相符者根据G或C评估结果随机接受化疗或免去化疗。本次我们报道了这类患者5年无远处转移生存率(DMFS)、无远处转移间隔时长(DMFI)及OS等数据。
MINDACT试验中纳入了12.3%(826/6693)pT1abN0患者。大于60岁者占37.5%,绝经后患者占63.6%。727/826标本有中心病理评估;浸润性导管癌80.5%,ER+91.1%,HER2+6.3%,肿瘤3级11.1%。根据IHC分子分型:luminial A型58.6%,luminial B型26.5%,luminial/HER2+5.2%,HER2+1.1%,HR-HER2-5.1%。几乎所有患者属于临床低风险(CL;99.3%),CL /GL 75.5%,CL/GH23.7%,CH/GH 0,缺失1。接受或拒绝化疗的CL/GH pT1abN0患者5年DMFS分别是97.3%和91.4%,5年DMFI和OS分别是98.8%vs.98.5以及91.4%vs.95.8%。
对于T1abN0肿瘤可以通过肿瘤生物学特性决定是否辅助化疗。23.7%临床低危但基因高危的小肿瘤患者可从化疗获益。
151PD-生物仿制剂ABP980和曲妥珠单抗于HER2+早期乳腺癌的疗效和安全性的对比分析
已证实ABP980与曲妥珠单抗(TRAS)在分解、功能和药动力学等方面相仿。本次是两者的初步疗效分析结果报道。
该随机对中心双盲试验的目的旨在对比HER2+早期乳腺癌患者使用ABP980或TRAS后的pCR。只有完成整个蒽环类方案化疗后的患者才能按1:1随机接受ABP980或TRAS联合紫杉醇Q3W/4周。主要终点包括原发灶及腋窝淋巴结pCR的风险差异性(RD)和风险比(RR)。如果RD和RR的双边90%CI在-13%~13%生物等效性范围内则认为两者临床疗效相仿。次要终点是安全性。
招募了827名患者,其中725名患者随机接受ABP980(n=364)和TRAS(n=361)。pCR可评估样本量为696(ABP980n=358;TRASn=338)。局部评估结果显示ABP980组和TRAS组的pCR分别为48.0%和40.5%。pCR的RD和RR分别是7.3%(90%CI:1.2%,13.4%)和1.19(90%CI:1.033,1.366)。中心独立评估结果是两组pCR分别是47.8%和41.8%,RD和RR分别是5.8%(90%CI:-0.5,12.0%)和1.14(90%CI:0.993,1.312)。≥1不良事件(AE)发生率分别是80.2%(ABP980)和79.5%(TRAS),≥3级AE分别是14.8%和14.1%。最常见AEs(ABP980 vs.TRAS)包括关节痛(17.3%vs.15.2%)、虚弱(14.8%vs.16.3%)、中性粒细胞减少(14.6%vs.12.5%)、周围神经病变(13.7%vs.11.9%)及贫血(11.0%vs.10.2%)。
新辅助ABP980和TRAS临床疗效相当,进一步证实了两者疗效和安全性相当。
152PD-随机双盲的III期临床试验对比曲妥珠单抗和生物仿制剂CT-P6治疗HER2+早期乳腺癌(EBC)的疗效和安全性
本次研究旨在评估两者疗效和安全性。
549名HER2+EBC患者随机接受CT-P6(n=271)或曲妥珠单抗(n=278)联合多西他赛(第1-4周期)序贯5-Fu、表柔比星和环磷酰胺(第5-8周期)。两者首次剂量8mg/kg,随后6mg/kg,Q3w。手术后,患者继续CT-P6或曲妥珠单抗单药10个周期。主要终点是pCR,次要终点是总反应率(ORR)、PK、PD和安全性。
CT-P6组和曲妥珠单抗组的pCR分别是46.8%和50.4%,PPS和ITT分析中组间差异的95%CI在等效范围内(±0.15)。超过1年治疗后的严重不良事件≥1的发生率分别是7.4%和11.9%。6名患者(两组各3名患者)因LVEF显著下降退出。注射相关不良反应发生率分别是11.4%和10.4%。

本研究证实CT-P6和曲妥珠单抗等效。新辅助或辅助CT-P6的安全性与曲妥珠单抗类似。
153PD-新辅助和辅助SB3生物仿制剂对比曲妥珠单抗治疗HER2+早期乳腺癌的1年安全性、免疫源性和生存预后结果
既往研究证实,就乳房pCR(bpCR)而言,SB3生物仿制剂与曲妥珠单抗(TRZ)等效。本次报道两者1年的安全性、免疫源性、无事件生存率(EFS)和OS结果。
比较新辅助8个周期的SB3或TRZ同时联用化疗(多西他赛4周期序贯4周期5-FU+表柔比星+环磷酰胺)。术后,患者随机使用10周期SB3或TRZ。主要终点是bpRC,次要终点是新辅助及辅助阶段的安全性、免疫源性、EFS和OS。
875名患者参加随机分配,中位随访时长是438天,765名患者完成辅助治疗(SB3,n=381;TRZ,n=384)。组间治疗相关的不良事件(TEAEs)发生率详见下表。新辅助阶段最常见的TEAEs包括脱发、中性粒细胞减少和恶心,辅助阶段则常见放疗相关皮损、操作相关疼痛和疲乏。SB3组和TRZ组的EFS分别是92.2%和91.6%。共6个死亡事件(SB3,n=1;TRZ,n=5)。两药的免疫源性均较低,无差异,抗药抗体阳性比例均为0.7%。

SB3和TRZ1年的安全性、免疫源性和生存预后无差异,证实两者的生物相仿性。
154PD-新辅助PF-05280014生物仿制剂或曲妥珠单抗联合多西他赛(D)和卡铂(C)治疗可手术的HER2+乳腺癌的随机双盲试验
本研究旨在对比新辅助曲妥珠单抗的生物仿制剂PF-05280014或欧盟来源的曲妥珠单抗(trastuzumab-EU)联合D+C于可手术HER2+乳腺癌中的疗效、安全性、免疫源性及药物动力学(PK)。
226名患者根据肿瘤体积、HR状态按1:1随机分为PF-05280014组和trastuzumab-EU组(首次8mg/kg,随后6mg/kg),两组均联合D(75mg/m2)和C(AUC=6),Q3w,共6周期。以第5周期Ctrough(第6周期治疗前)>20μng/ml的比例评估PF-05280014是否不亚于trastuzumab-EU。通过pCR(新辅助治疗后乳房及淋巴结中不存在浸润成分)和客观反应率(ORR)评估两者的疗效。
PF-05280014组和trastuzumab-EU组第5周期Ctrough>20μng/ml的比例分别是92.1%和93.3%。组间95%CI(-8.02%-6.49%)下限高于非劣效边界值(-12.5%)。两组pCR分别是47.0%和50.0%。中心影响评估的ORR分别是88.1%和82.0%。3-4级全因治疗相关不良事件发生率分别是38.1%和45.5%。两组的抗药抗体滴度阳性率分别是0和0.89%(n=1)。
PF-05280014在疗效、安全性和免疫源性方面与trastuzumab-EU等效,PK不亚于后者。另一个研究(NCT01989676)是比较一线PF-05280014和 trastuzumab-EU联合多西他赛治疗HER2+转移性乳腺癌的疗效和安全性。
155PD-HER2+早期乳腺癌患者新辅助拉帕替尼+曲妥珠单抗零化疗方案后肿瘤周围浸润淋巴细胞(TILs)研究:PAMELA试验
HER2+早期乳腺癌患者接受以抗HER2治疗为基础的化疗后出现TILs数目增加,提示pCR和预后好。关于单纯新辅助HER2靶向治疗TILS的改变与乳房pCR(pCRB)的相关性目前仍是未知之数。
前瞻性研究PAMELA试验旨在评估PAM50固有分型(IS)预测新辅助拉帕替尼+曲妥珠单抗(若HR+则联合内分泌治疗)后pCRB的能力。以连续变量及分类变量(TILs<50%为低水平,>50%为高水平)表示的TILs水平变化与pCRB相关。
入组151名患者,其中治疗前(BS)TILs可评估样本量为148,治疗第15天(D15)时样本量为134。治疗前,TILs中位水平是10%(5-20)。根据IS分布的中位TILs:HER2-E(10%)、luminal A(7.5%)、luminal B(5%)、基底样型(5%)(p=0.02)。HR-肿瘤(10%,1-20)的TILs水平高于HR+肿瘤(5%,1-20),尽管无统计学意义(p=0.07)。TILs高水平组和低水平组的pCRB分别是58.3%和27.2%(p=0.03)。单因素分析显示,治疗前TILs水平与pCR相关。D15时中位TILs水平为15%(5-30),不同IS分型中均有上升(p<0.01)。D15使各IS分型的TILs水平分布:HER2-E(20%)、luminal A(10%)、luminal B(7.5%)、基底样型(20%)、正常腺体型(10%)(p=0.37)。TILs高水平组和低水平组的pCRB分别是65%和21.1%(p<0.01)。当TILs水平以连续变量分析示,D15时TILs高水平及治疗后出现TILs水平改变与高pCRB相关,与HR状态及IS分型无关(p<0.01)。对于HR-或HR+亚型患者D15的TILs水平均与pCR显著相关。
D15出现的TILs是HER2+早期乳腺癌患者新辅助HER2靶向治疗零化疗方案后pCRB的独立预测因素。
156PD-靶向二代测序(NGS)探索高复发风险早期乳腺癌(eBC)的基因突变
通过临床特征判断eBC患者是否需要辅助化疗的方法不能准确识别高复发风险人群。USO01062III期试验纳入了2611名临床高危患者,复发率为13%。通过比较有无复发患者肿瘤的基因突变情况,可能会发现复发相关的突变基因,识别高危人群。目前对TNBC基因表达知之甚少,NGS可能有助于发现新的治疗方案。
USO01062研究结果显示增加辅助卡培他滨未带来获益(O’Shaughnessy J.et al.2015)。从该研究1181份肿瘤标本中提取DNA和RNA,用FoundationOne
®
靶向NGS检测145名获得DFS患者及146名基线匹配无DFS患者的基因表达。既往基因表达情况用乳腺癌特异的800基因组检测(Wilson T.R.et al. 2016)。
针对各IHC分子分型的体细胞基因突变分析显示ATM、ERCC4和IGF2R等基因突变提示高危HR+乳腺癌,MAP3K1、RPTOR和LYN基因突变提示高危TNBC。肿瘤突变负荷(TMB)分析显示TNBC负荷最大,与临床预后、PDL1和CD8基因表达均无相关性。TNBC的分子分型(Lehmann B.D.et al.2011)均具有各自不同的驱动基因,如TP53和MYC突变最常见于BL1和BL2分型。TP53、CREBBP和BRCA1突变见于IM分型。PIK3CA和PTEN突变见于LAR分型。
TMB不是预后因素且与PDL1或CD8基因表达不相关,表明TMB不能作为识别TNBC免疫激活亚型的因素。TNBC分子分型均有不同的驱动基因,表明不同亚型均存在基因异质性。对比有无DFS患者的基因突变情况可能识别出高危人群。
157PD-常规应用基因标记物——RASTER研究的10年随访结果
2004年,RASTER试验利用70基因标记MammaPrint
®
(MP)预测乳腺癌(BC)远处复发风险。患者(cT1-3N0M0)及其医生根据丹麦临床指南及MP结果决策是否辅助系统治疗(AST)。5年随访结果显示MP(Drukker,Int J Cancer,2013)具有预后预测价值。本次公布10年随访结果。
427名患者年龄<61岁,10年生存数据齐全。本次分析中,临床高危或低危风险根据Adjuvant!Online修正版(Cardoso,N EngL J Med,2016)评定。对比不同复发风险(根据MP和临床评定)亚组间10年无远处复发率(DRFI)。
MP和Adjuvant!Online评定的基因低危和临床低危比例分别是51.4%和57%。基因低危和高危人群10年DRFI分别为93.7%和86.8%,而临床低危和高危人群的10年DRFI分别是91.7%和88.2%。临床低危且基因低危患者10年DRFI为94.4%,其中仅有11.6%患者接受AST。临床低危/基因高危组10年DRFI为88.5%,>90%患者接受AST。临床高危/基因低危组及临床高危/基因高危组的10年DRFI分别是90.9%和87.3%。基因高危和基因低危的ER+BC患者10年DRFI分别是87.3%和90.9%,而临床高危和临床低危的ER+BC患者10年DRFI粉笔是91.9%%和91.6%。
MP低危患者免去化疗,10年DRFI非常好,证实了MP的预后预测价值。对于临床高危患者,MP可甄别出10.8%基因低危患者,若ER+则可免去化疗。与基因风险评估相比,临床风险评估无法区分临床高低危ER+BC患者的生存获益。
158PD-绝经前HER2+早期乳腺癌(EBC)患者辅助抗HER2治疗、治疗相关贫血(TIA)及生存获益相关性分析:ALTTO试验(BIG2-06)结果
对于绝经前HER2+EBC患者,TIA与预后相关性、曲妥珠单抗(T)和拉帕替尼(L)的性腺毒性目前仍是未知。本研究旨在探索TIA的预后预测价值以及T或/和L与TIA相关性。
ALTTO研究是国际开放随机III期试验,纳入HER2+EBC患者,随机分配到4个辅助抗HER2组:单T、单L、T序贯L、T+L。在随机分配时及治疗第37周评估所有患者的绝经状态。在随机分配时我们仅挑选绝经前患者,本研究旨在探讨HR+及HR-EBC患者的TIA是否与DFS和OS相关以及导致TIA的风险因素。
本次分析纳入了2862名患者。中位年龄43岁。59%为HR+EBC患者。出现TIA的HR+HER2+EBC患者DFS和OS均优于无TIA者。对于HR-HER2+EBC患者,有无TIA与DFS和OS均无相关性。4个治疗组间的TIA发生率无差异。年龄增加(p<0.001)、紫杉类+蒽环类化疗方案(p<0.001)、辅助内分泌治疗(p<0.001)均增加TIA风险。
对于绝经前HR+HER2+EBC患者,TIA带来显著生存获益。抗HER2药物与TIA发生风险无相关性。该结果对于肿瘤病人生育策略指导具有重要意义,支持辅助卵巢功能抑制用于HR+HER2+RBC患者。
159PD-新辅助T-DM1+帕妥株单抗治疗HER2+原发乳腺癌(JBCRG-20)
探索新辅助化疗联合抗HER2治疗是否能提高pCR具有重要意义。本研究探讨T-DM1、帕妥株单抗及根据治疗反应调整的治疗方案于HER2+原发乳腺癌(cT1c-T3,cN0-N1,M0,T≤7cm)中的疗效。
本研究旨在评估3个方案的疗效和安全性:A)TCbHP6周方案;B)TCbHP4周期序贯4周期T-DM1+P;C)6周期T-DM1+P:4周期治疗显效者再增加周期T-DM1+P(C1),无效者改为4周期CEF(C2)(表)。治疗显效标准:肿瘤体积(MRI)缩小≥30%,粗针穿刺活检是Ki67≤10%或无残存肿瘤细胞。ER+患者同时接受内分泌治疗及T-DM1+P。中心实验室测定HER2、ER状态及Ki-67值。主要终点为pCR率(yT0-is,yN0)。次要终点是安全性、ORR、保乳率。
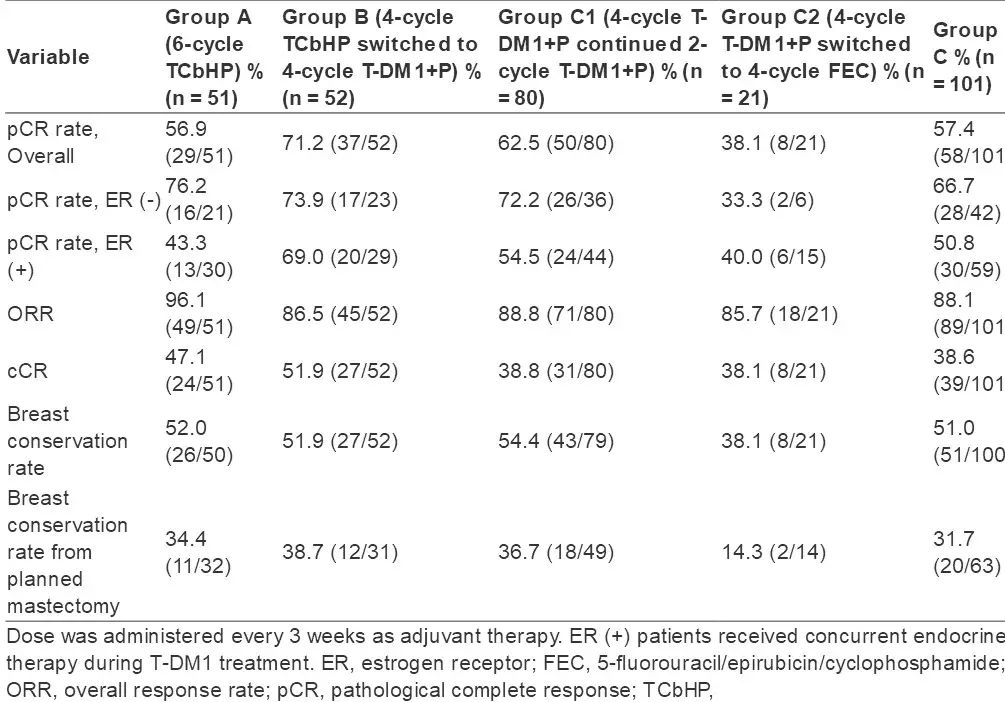
共纳入206名患者。各组患者基线资料相当(中位年龄53.0岁,绝经后患者比例53.9%,T2比例70.6%,中位肿瘤体积26mm,N0比例63.2%,ER+比例57.8%)。79.2%C组病人因疗效显著继续T-DM1+P方案。A、B、C组的pCR率分别是56.9%、71.2%和57.4%。探索性分析显示对于ER+患者,B、C1方案pCR率高于A方案,对ER-患者,三种方案的pCR率无差异。各组间的次要终点无差异。各组的药物相关严重不良事件发生情况无差异,无患者因不良事件终止治疗。值得一提的是:C1方案的药物相关脱发(5.0%vs。81%-94%)、粒细胞减少性发热(0%vs.15%-33%)发生率均低于A、B、C2方案。
标准TCbHP方案+T-DM1+P可能优于TCbHp方案。与TCbHP方案相比,个体化T-DM1+P方案疗效相当、毒性更低。
乳腺癌(BC)脑转移(BCBM)是导致并发症及降低总体生存率的主要因素。假设有一个临床风险预测模型可以预测BCBM,甄别出BCBM高风险的早期BC人群,开展预防性研究。
回顾性分析1997-2014年在MD Anderson癌症中心确诊早期乳腺癌并接受治疗的患者的资料。将患者年龄、HER2状态、HR状态、肿瘤组织学、分级和分期、绝经状态、脉管及淋巴管浸润等临床病理因素纳入多因素Cox比例风险回归模型进行分析。
共收集15164名患者资料,按2:1随机分为模型建立组(n=10026)及验证组(n=5138),两组分别有317和133名患者出现BCBM。模型建立组中,10年预估脑转移风险为4.2%。年轻、HER2-、HR-、高级别肿瘤、肿瘤分期高均是BCBM独立风险因素。在验证组,风险预测模型的预估Harrell‘s一致性指数为81%。根据模型,验证组中10%为高危患者,10年脑转移风险为15%。
早期BC的脑转移风险预测模型的作用:(1)可识别BCBM相关的临床风险因素;(2)利用这些风险因素计算出每个个体BCBM风险值;(3)选出BCBM高危人群优先进入预防性试验。
161PD-评估乳腺癌辅助治疗的随机对照试验中OS的替代终点研究:荟萃分析
研究癌症的随机对照试验(RCT)中,终点指标除了OS,利用其他指标如DFS作为主要研究终点日益增加。这是由于减少样本量、缩短试验时间、降低成本所需。但这需要通过严格验证才能作为OS的替代终点。对于乳腺癌辅助治疗中,碍于整合资料有限,仅有部分研究评估OS的替代终点。本次荟萃分析的目的在于此。
根据5个III试验的荟萃分析,我们评估了4个OS的替代终点:无复发生存率(RFS)、浸润癌DFS、局部区域RFS及远处DFS。患者个体层面,我们通过连接函数评估各替代终点与OS的相关性。试验层面,我们通过线性回归模型及Burzykowski、Molenbergh和Buyse三人提出两步法研究各替代终点与OS的相关性。
综合5个RCT共11676名患者数据,患者个体层面每个替代终点均与OS高度相关(r≥0.98)。试验层面,与其他替代终点相比,浸润性DFS与OS的相关性更高(R2WLR=0.78;R22SM=0.87)。
这是首个荟萃分析从患者个体层面评估乳腺癌辅助治疗后OS的替代终点。结果提示上述的结局指标均可作为OS的候选替代终点,但仍需通过大型试验改善我们的模型在试验层面的估算精确度。
162PD-根据Lehmann’s更新分类系统(TNBC4型法)评估三阴性乳腺癌新辅助卡铂联合多西他赛方案的病理缓解情况
三阴性乳腺癌(TNBC)是乳腺癌中具有侵袭性的亚型,需要预测生物标记物评估新辅助化疗(NACT)治疗反应。本研究旨在评估TNBC4型法对新辅助卡铂+多西他赛(TCb)治疗TNBC疗效的预测价值。
本研究为非随机试验(NCT01560663),入组的I-III期TNBC患者(ER和PR<1%,HER2-)接受新辅助卡铂(AUC=6)和多西他赛75mg/m2,Q3W。pCR定义为乳房及腋窝淋巴结中无浸润癌残留(ypT0/isypN0)。肿瘤肿瘤负荷法(RCB)(Symmans et al 2007)评估残留病灶。从石蜡包埋的粗针穿刺标本中提取mRNA进行测序,测序结果上传到TNBC4型法在线工具(http://cbc.mc.vanderbilt.edu/tnbc)。
纳入了121名患者,其中94名患者RNA测序数据可用。确诊时中位年龄51岁,淋巴结受累69.1%,II期和III期病例分别为52.1%和46.8%。pCR和病理缓解显著率(pCR或RCBI)分别为44.7%和56.4%。TNBC4型比例分别是:34.0%BL1、20.2%BL2、23.4%M和14.9%LAR。另外7.4%归类为ER+。BL1与确诊时年轻、高Ki-67值相关。TNBC4型法与NACT反应显著相关(p=0.027),在包含肿瘤体积和淋巴结状态的多因素分析中,BL1患者pCR率(65.6%)最高,其次是BL2(47.2%)。相反,LAR(21.4%)和ER+(14.3%)患者pCR率最低。LAR/BL1、M/BL1的pCR率OR值分别是0.14和0.30(p<0.05)。
TNBC4型法可有效预测TNBC患者新辅助TCb治疗反应,BL1亚型反应最佳,LAR亚型反应最差。
163PD-三阴性(TNBC)和HER2+早期乳腺癌新辅助卡铂方案的II期随机试验——远期生存预后分析
GeparSixto试验显示蒽环+紫杉类新辅助化疗方案中加入卡铂(Cb)可改善TNBC患者pCR(ypT0ypN0)率,并转化为早期DFS改善。但对于HER2+乳腺癌患者,加入Cb后,pCR和DFS并未改善。本次报道远期生存分析结果。
GeparSixto试验中,患者接受18周期的紫杉醇(80mg/m2)Q1w+非脂质体多柔吡星(NPLD,20mg/m2) Q1w (PM)+贝伐单抗15mg/kgQ3w(TNBC)或曲妥珠单抗6/8mg/kgQ3w+拉帕替尼750mg/d(HER2+)。595名患者按1:1同时随机进入Cb 组AUC1.5-2.0Q1w(调整样本量至330使AUC降至1.5)和无Cb组,并根据HER2+和TNBC分层。主要终点是pCR(ypT0ypN0)。DFS、远侧DFS(DDFS)、无局部区域复发生存率(LRRFS)和OS为次要终点。
中位随访时间47.3个月,PMCb组和PM组的DFS无统计学差异。TNBC患者接受PMCb方案后DFS和DDFS显著提高。Cb加入带来的获益未见于HER2+患者。TNBC患者OS曲线有改善趋势。有无卡铂组的OS无显著差异。多因素分析提示pCR是DFS、DDFS和OS的独立预测因素。
远期生存分析结果支持TNBC患者使用含Cb的新辅助方案。pCR对DFS和OS有较强的预测价值。
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情






