丽珠医药集团7月31日公告称,控股子公司珠海市丽珠单抗生物技术有限公司(简称“丽珠单抗”)在研新药注射用重组人源化抗PD-1单克隆抗体(LZM009)的临床研究申请(受理号 IND 133742)获得美国FDA批准,可以在美国进行临
床研究。
LZM009是丽珠单抗具有自主知识产权的新药品种,该品种分子序列及用途专利已申请中国和PCT专利。
丽珠单抗
于美国时间2017年6
月29日正式向FDA提交
“注射用重组人源化抗PD-1单克隆抗体”的临床试验申请
并获得受理,并于美国时间
2017年7月28日获得FDA正式批准。
丽珠单抗在申报临床试验过程当中,与境外CRO机构进行了充分沟通,并签 订了临床试验委托合同,确定了临床试验医疗机构。本次丽珠单抗取得临床试验 批准以后,将与境外CRO机构及临床试验医疗机构一同积极推动“注射用重组人 源化抗PD-1单克隆抗体”药物在美国临床试验的实施。
2016年12月20日,丽珠单抗向CFDA提交LZM-009临床试验申请,并于12月26日获得受理(受理号:CXSL1600125粤)。目前处于在审评阶段。
根据医药魔方数据库,目前在国内申报的以 “PD-1/PD-L1”为靶点的单抗药物的临床试验厂家共计15家。
国内企业申报的PD1/PD-L1药物及研发阶段
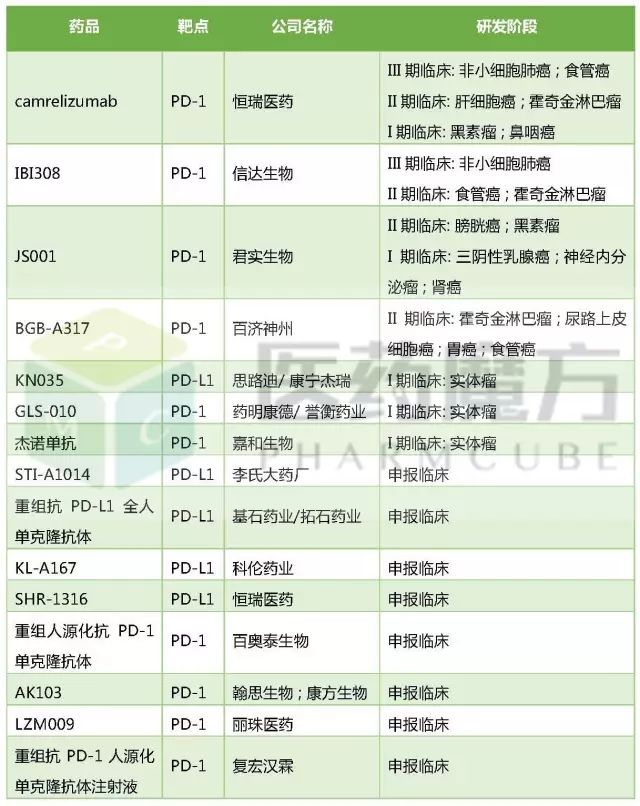
截至2017年7月31日,丽珠单抗在LZM009项目上已累计投入研发费用约2748.52万元人民币。
相关阅读
PD-1市场最新态势——蛋糕快速变大,O-K差距明显缩小





