作者 l
吃瓜群众
编辑
l
细胞房间
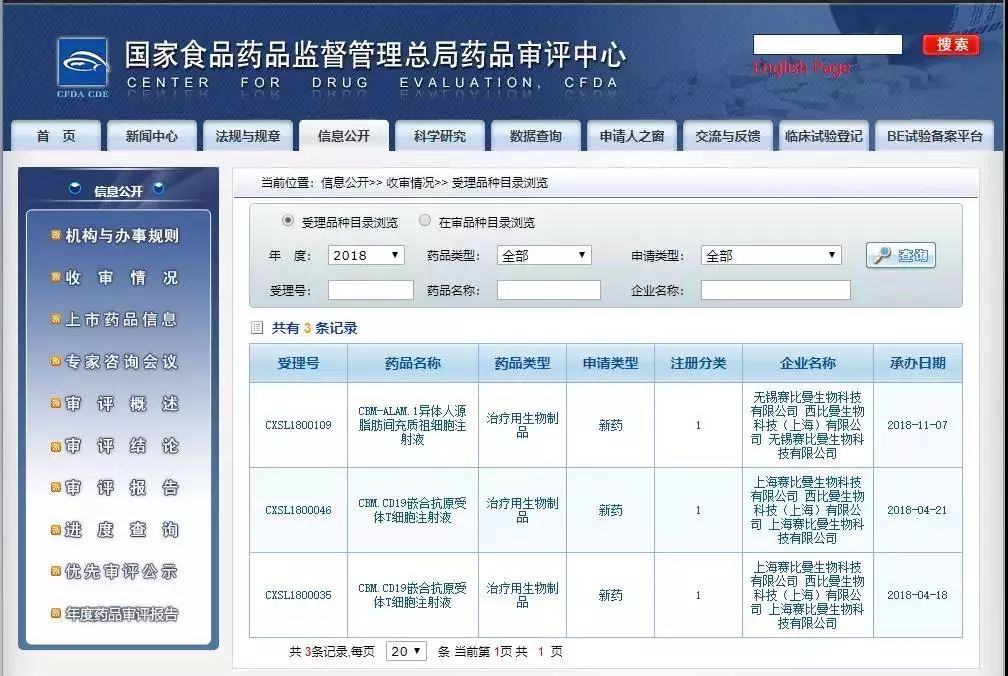
本月16日,西比曼生物科技集团公司(Cellular Biomedicine GroupInc,以下简称:西比曼)的CBM-ALAM.1异体人源脂肪间充质祖细胞注射液获得国家药品监督管理局临床试验默示许可(批件号 CXSL1800109),用于治疗膝骨关节炎(Knee Osteoarthritis,KOA)!
路在何方?
一直以来,干细胞是按照第三类医疗技术还是药物管理存在很大争议。反对者认为,对于像干细胞这样“活的产品”,很难按照药物的形式进行管理。然而,国际上首个干细胞药物于2011年获批;2018年初,武田的Alofisel(异体脂肪干细胞)获得欧盟批准,用于克罗恩病患者复杂性肛瘘的治疗。就在前几天,尽管FDA由于经费问题停止工作,FDA局长“义务劳动”,发布关于促进细胞和基因治疗开发的新政,预计到2020年每年受理200个以上IND,到2025年每年批准10~20种细胞和基因治疗产品。新年伊始,这针鸡血不可谓不猛。
方向逐渐清晰
2011年底,国家全面叫停各类干细胞临床研究和应用;2015年出台《干细胞临床研究管理办法》。从那时起,国内干细胞药物研发才逐步走上正轨。实际上,早在2004年,CDE就受理了首个干细胞药物IND申请,只是在干细胞临床应用乱象的大背景下不了了之。
《干细胞临床研究管理办法》指出了IND申报之外的另一条开展干细胞临床研究的途径,一般被业内人士称为“双轨制”。只是《办法》明确规定,干细胞临床研究不得收费,相关资料可用于IND申报。因此,药物研发是干细胞临床应用的最终出口,也是唯一的合法变现途径。
靴子落地
2018年6月,国内首个干细胞新药人牙髓间充质干细胞产品注册申请得到了国家药审中心的审评受理(受理号CXSL1700137)。截止去年年底,CDE共受理了5个干细胞药物的IND申请,包括西比曼的CBM-ALAM.1异体人源脂肪间充质祖细胞注射液(11月17日获得受理)。
意料之外、意料之中
对于国内首个获得受理的干细胞新药,三有利可谓起了个大早,赶了个晚集。早在2016年,三有利就向北京药监局递交了IND申请,后来撤销;又在2年后重新向CDE申报,并获得受理。根据CDE官网公布的信息,该品种已经完成申报资料审评,估计在发补资料中。
西比曼为什么能拔得头筹呢?熟悉这家公司历史的会觉得实至名归。早在2011年,曹卫就创办了西比曼,主攻干细胞药物研发。然而在2016年,西比曼更换了CEO,创始人曹卫出局。虽然具体原因不为外界所知,持续烧钱、缺乏可盈利的商业模式应该是促使创始人和投资人分道扬镳的根本原因。2017年底,CAR-T药物火起来后,西比曼也在这方面展开布局,2个CAR-T药物的IND申报于2018年获得CDE受理。和一般CAR-T药物研发公司不同,西比曼同时布局CAR-T和干细胞药物两个板块,既发挥了公司在干细胞药物研发这方面积累的优势,又丰富了产品线,可谓明智之举。
从技术层面分析,骨关节炎是干细胞药物研发领域公认的首选适应症之一,并且韩国早在2012年就批准了异体脐带血来源的间充质干细胞,用于治疗骨关节炎。2018年,欧盟批准了异体脂肪干细胞药物。因此,西比曼的CBM-ALAM.1在药物形式和适应症方面都做了精准的布局,这也是其能顺利获批批件的重要原因。
任重道远
尽管获得临床批件,而且可以直接开展II期临床,并不意味着西比曼从此可以高枕无忧了。进入临床(尤其是晚期临床),意味着研发投入大大增加,这方面考验着公司的融资能力。另外,从韩国治疗骨关节炎干细胞药物的销售情况来看,数据并不乐观。因此,即使CBM-ALAM.1能获批上市,是否能快速回收研发成本并盈利,仍然存在很大不确定性。最后,西比曼目前布局的专利壁垒,能否挡住后来者进入骨关节炎干细胞治疗这个领域。考虑到间充质干细胞可以从多个组织分离,小编对CBM-ALAM.1的专利壁垒心存担忧。
小结
2017年底,南京传奇获得国内首张CAR-T药物临床批件,拉开了国内细胞药物研发的大幕。西比曼的IND获批,给细胞药物研发这个领域又开辟了一条新的赛道,避免资金、人员都拥堵在已经拥挤不堪的CAR-T药物领域(特别是CD19靶点)。尽管道路不会一帆风顺,细胞药物时代正在来临!
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。


















