
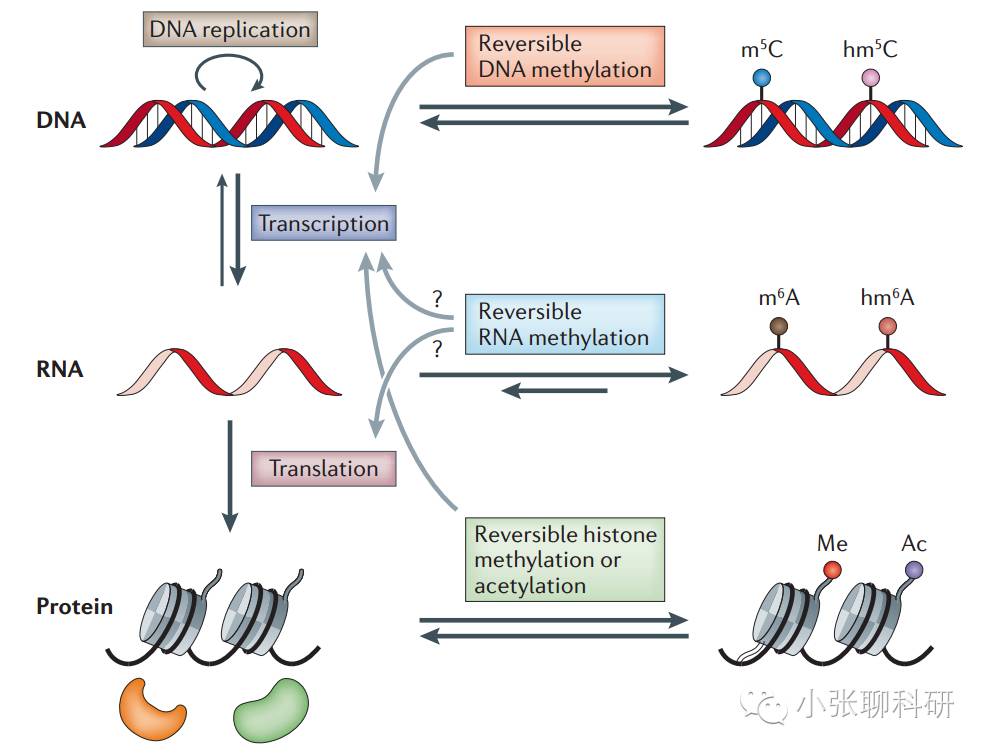
今天我们要讲的主题是RNA的甲基化修饰。是的,不是DNA不是蛋白,也不是前面我们介绍过的microRNA、lncRNA与甲基化((策略篇)甲基化:一个与lncRNA剪不断理还乱的主题,(文章篇)S3E15: 组蛋白甲基化修饰在lncRNA水平调控中的作用),就是RNA水平的甲基化修饰。
1. 什么是RNA甲基化修饰?
我们知道DNA的甲基化修饰是发生在胞嘧啶(C)上的,而最常见的RNA的甲基化修饰是m6A(N6-methyladenosine,6-甲基腺嘌呤)和尿苷化修饰(uridylation,U-tail)。
m6A修饰在70年代就发现了,是可以发生在mRNA、lncRNA等RNA的腺嘌呤(A)上的甲基化修饰,在哺乳动物中,发生 m6A修饰的腺嘌呤A比例为0.1–0.4%,算起来每条mRNA只有3-5个m6A甲基化位点。而U-tail是发生在
RNA的尿嘧啶修饰,通常与RNA的降解过程有关。
哺乳动物和酵母中的m6A位于mRNA终止密码子附近和3’非翻译区。RNA修饰能够在转录后水平上调控RNA的稳定性、定位、运输、剪切和翻译,比如mRNA的翻译和选择性剪接,microRNA的成熟等。
DNA和组蛋白的表观遗传学修饰主要在转录水平上起作用。而可逆的RNA甲基化主要在转录后水平上调控基因表达。
2.RNA甲基化修饰的参与者有哪些?
在RNA甲基化修饰过程中,有三类分子参与其中:Writers, Erasers和Readers:
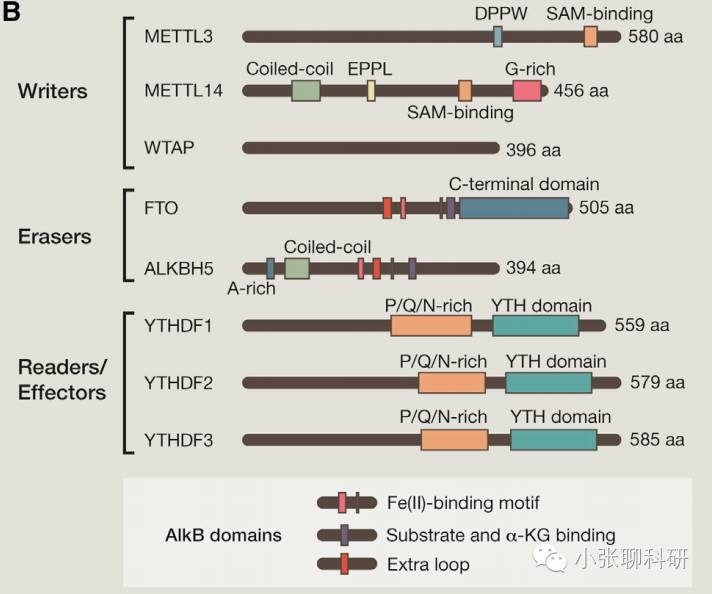
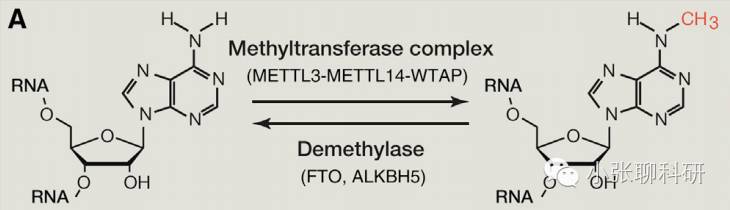
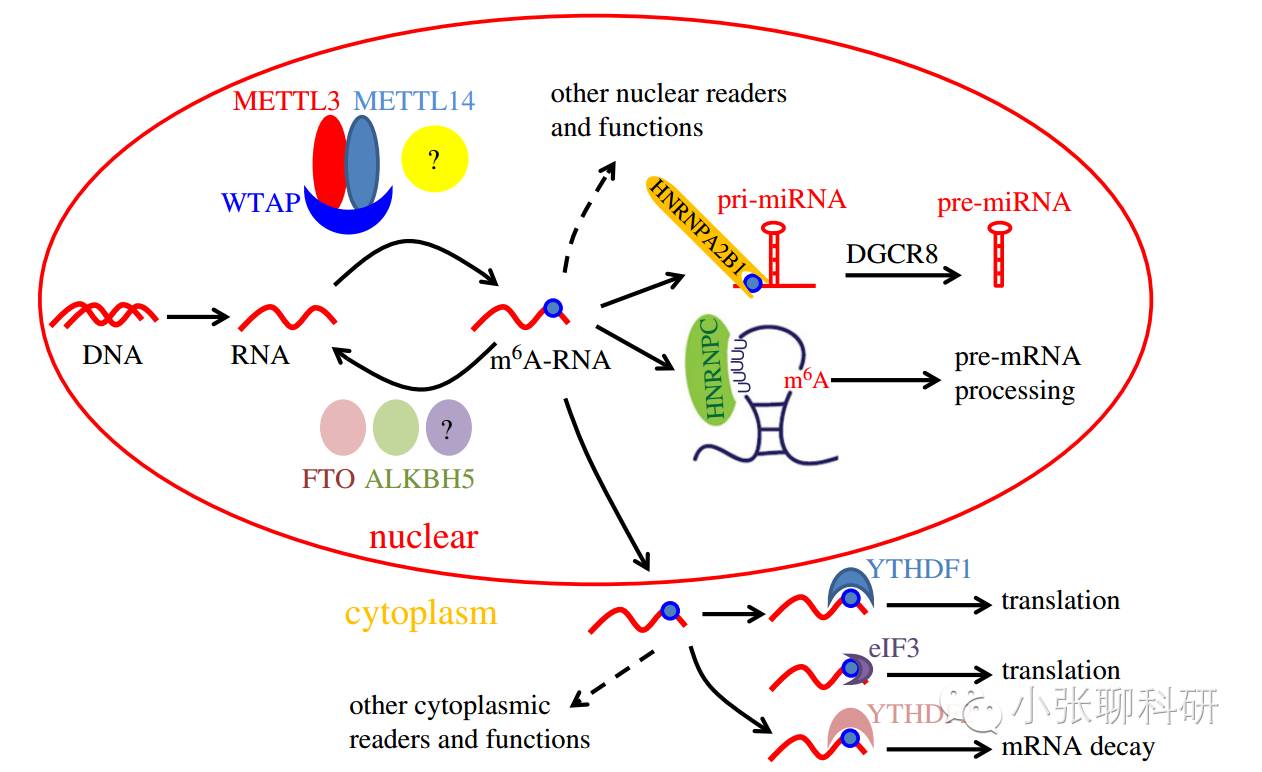
Writers:将甲基化修饰“写入”RNA,即介导RNA的甲基化修饰过程。最常见的分子是METTL3和METTL14,两者可在体外和体内催化mRNA(和其他细胞核RNA)的m6A甲基化。WTAP是这种甲基转移酶复合体中的另一个关键组分。
Erasers:将RNA甲基化修饰信号“擦除”,即介导RNA的去甲基化修饰过程。FTO和ALKBH5可以去除mRNA(和其他细胞核RNA)上的m6A甲基化。
Readers:“读取”RNA甲基化修饰的信息,并参与下游RNA的翻译、降解等过程。比如具有YTHDF结构域的蛋白能够识别并结合mRNA中的m6A,而这种结合会减少mRNA的半衰期促使其降解。
3. 检测RNA甲基化修饰的实验方法有哪些?
MeRIP–Seq(m6A RNA immunoprecipitation,或m6A-Seq):首先通过m6A特异性的抗体进行免疫沉淀富集,然后通过高通量测序的方法进行分析,以检测发生m6A修饰的RNA转录本。该方法可将m6A残基定位在100–200 nt的转录本区域中,无法在全转录组水平上鉴定m6A的精确位置。

miCLIP(m6A individual-nucleotide-resolution Cross-Linking and ImmunoPrecipitation):含有m6A的RNA与相应抗体结合以后,通过紫外进行交联,反转录得到的cDNA会出现突变或者截断,这样就可以指示m6A的存在。该方法的分辨率为单核苷酸水平。
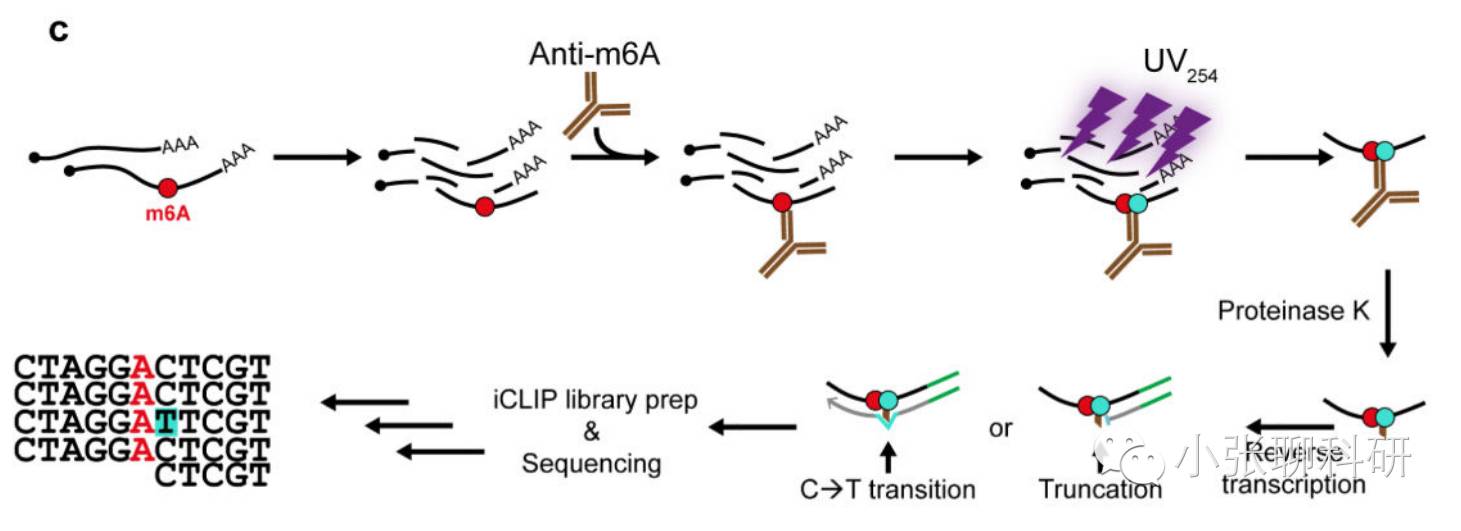
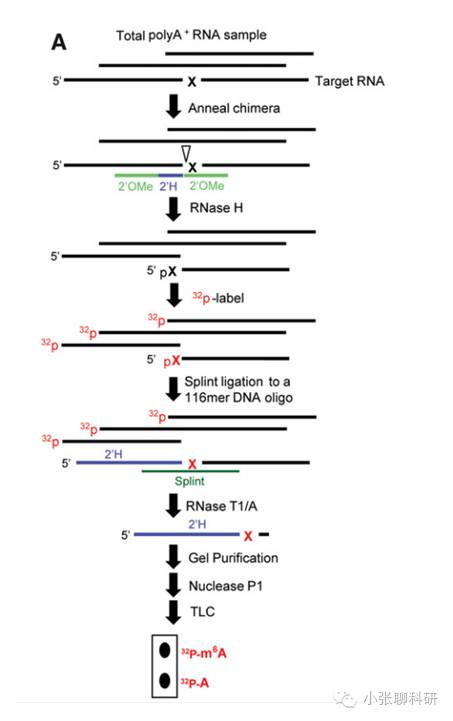
SCARLET(Site-specific Cleavage And Radioactive-Labeling followed by
ligation-assisted Extraction and Thin-layer chromatography)
通过结合位点特异性的RNA酶H、放射标记和TLC(薄层层析)的方法,对RNA甲基化修饰进行检测,该方法是从单基因通量下检测RNA的甲基化修饰。
4. 关于RNA甲基化的研究,发表的文章状况是怎样的?
由于RNA甲基化是早发现、刚重视的RNA甲基化修饰,所以相关的研究是非常新的,所以近几年有很多的高分文章:
Comprehensive analysis of mRNA methylation reveals enrichment in 3' UTRs and near stop codons.Cell. 2012 Jun 22;149(7):1635-46.
Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq.Nature. 2012 Apr 29;485(7397):201-6.
N6-methyladenosine marks primary microRNAs for processing.Nature. 2015 Mar 26;519(7544):482-5.
Emerging roles of RNA modification: m(6)A and U-tail.Cell. 2014 Aug 28;158(5):980-7.
Gene expression regulation mediated through reversible m⁶A RNA methylation.Nat Rev Genet. 2014 May;15(5):293-306.
Coordination of m(6)A mRNA Methylation and Gene Transcription by ZFP217 Regulates Pluripotency and Reprogramming.Cell Stem Cell. 2015 Dec 3;17(6):689-704.
m(6)A RNA methylation is regulated by microRNAs and promotes reprogramming to pluripotency.Cell Stem Cell. 2015 Mar 5;16(3):289-301.
Nuclear m(6)A Reader YTHDC1 Regulates mRNA Splicing.Mol Cell. 2016 Feb 18;61(4):507-19.
……
5. 有关RNA甲基化修饰的基金中标情况如何?
关于RNA甲基化修饰的国自然基金,我们一共检索到13项,其中RNA m6A修饰的国自然基金有10项,2015和2016年各5项:
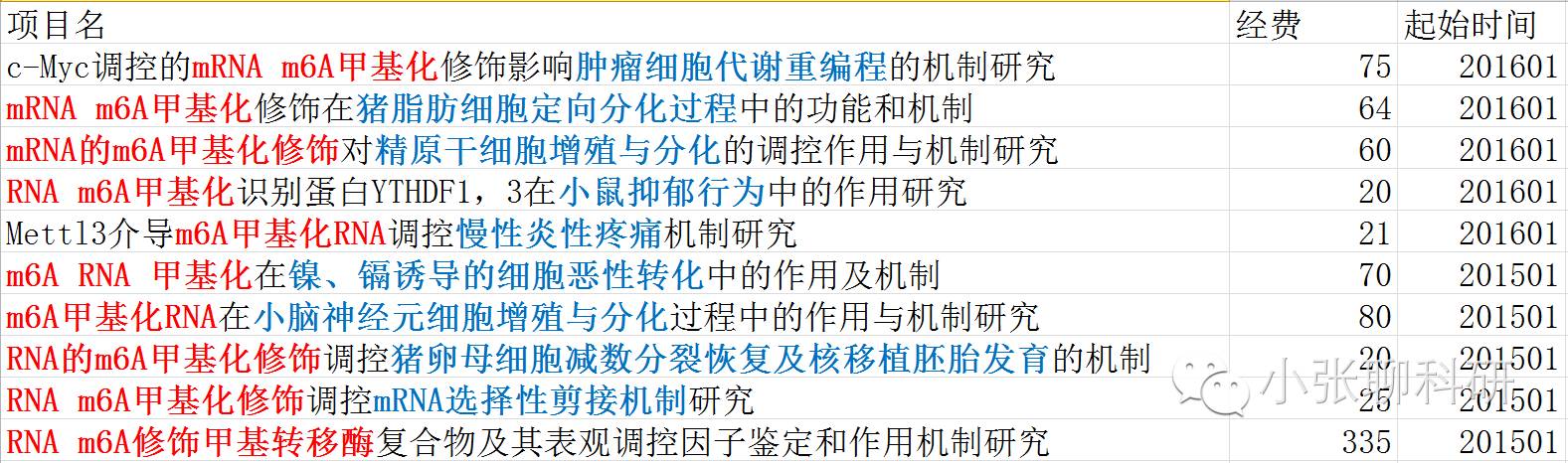
从基金申请的情况来看,涉及的疾病有:肿瘤、抑郁和慢性炎性疼痛,基础方向为主要是(干)细胞的分化和RNA的选择性剪接。
关于RNA U-tail修饰的国自然基金有3项:

关于RNA U-tail修饰的研究以生命科学的研究为主,项目比较少。
6.如果想选RNA甲基化作为方向设计课题,可以从哪些方面着手?
总体来看,以RNA甲基化修饰为主题的基金申请还是一个蓝海, 因此如果想选RNA甲基化修饰作为研究方向设计课题,可以从以下四种思路着手:
1. 研究RNA甲基化修饰过程中的参与者(Writer、Eraser和Reader)分子在疾病或者某一生命过程中的功能。比如:Mettl3介导m6A甲基化修饰调控慢性炎性疼痛机制研究。
2. 通过MeRIP–Seq/miCLIP等方法首先揭示疾病或者某一生命过程中RNA甲基化修饰的变化,即揭示疾病特异性m6ARNA甲基化图谱。
3. 揭示疾病或者某一生命过程中某一基因的特定RNA甲基化修饰与疾病的关系。即:RNA甲基化修饰——基因转录后调控(比如选择性剪接或者翻译,再或者microRNA的产生过程)——基因表达异常——疾病或者某一生命过程。
4. 鉴定参与RNA甲基化修饰的新分子,或者建立研究RNA甲基化修饰的新方法。
以上四种思路的研究难度是逐渐增加的,大家如果想选RNA甲基化修饰来作为研究方向,可以考虑逐渐增加难度,其中4建立新方法或者鉴定新分子可以说是科学家的工作了。下次我们选一篇第3种思路的文章进行介绍。
最后进行风险提示:由于RNA甲基化修饰非常新,好的方面是研究少,创新性很好找,坏的方面是方法尚不够成熟,入行需谨慎!
长按二维码识别关注“小张聊科研”

关注后获取《科研修炼手册》1、2、3、4、5,基金篇、生信特辑。













