
来源:
赛柏蓝器械
身处医疗器械行业,各种监管法律法规层出不穷,不知道哪些行为容易被药监部门盯上?不知道一旦犯错会被施加何种处罚?哪些情形下可以从轻或者减轻处罚?哪些情形下又会被从重处罚?如何从轻、从重罚款?山东省药监局的一个最新文件,可以一次性帮你解决诸多困惑。
5月26日,山东省药监局公布了《山东省食品药品行政处罚裁量基准(医疗器械)(征求意见稿)》,于2017年6月10日前面向社会公开征求意见。
山东省药监局的《征求意见稿》处罚依据和种类内容均来自医疗器械监管条例等行业法律法规,是可以视为通用处罚标准的,全国各地大同小异,也不会相差太多。
同时,该《征求意见稿》是为了适应2015年以来国家和省级一系列新颁法律法规而组织修订的,也就代表了药监行使行政处罚裁量权的新趋势。
《征求意见稿》中共列有28大项医疗器械生产、经营和使用违法违规行为,覆盖面极广,可以说医疗器械企业和医疗机构日常会犯的问题都一一在列了。对业内企业和人员来说,总有一款是符合你的。
以下为针对各种违法行为的“明码标价”罚款详情:
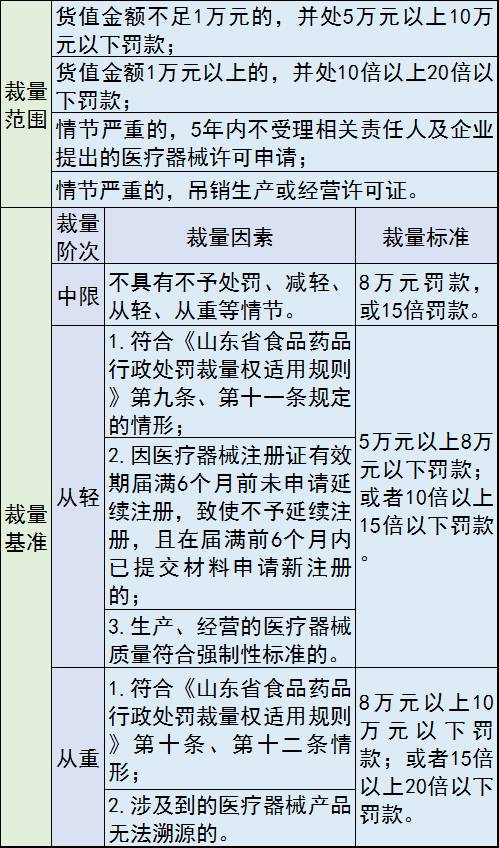
1、生产、经营未取得医疗器械注册证的第二类、第三类医疗器械
处罚措施包括:没收违法所得、违法生产经营的医疗器械和用于违法生产经营的工具、设备、原材料等物品;并处罚款;情节严重的,5年内不受理相关责任人及企业提出的医疗器械许可申请;情节严重的,由原发证部门吊销医疗器械生产许可证或者医疗器械经营许可证。
罚款“价格表”:
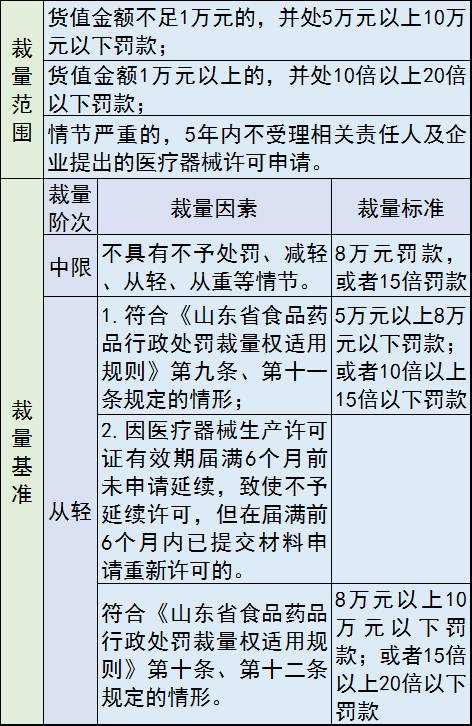
2、未经许可从事第二类、第三类医疗器械生产活动
处罚措施包括:没收违法所得、违法生产的医疗器械和用于违法生产经营的工具、设备、原材料等物品;并处罚款;情节严重的,5年内不受理相关责任人及企业提出的医疗器械许可申请。
罚款价格表:
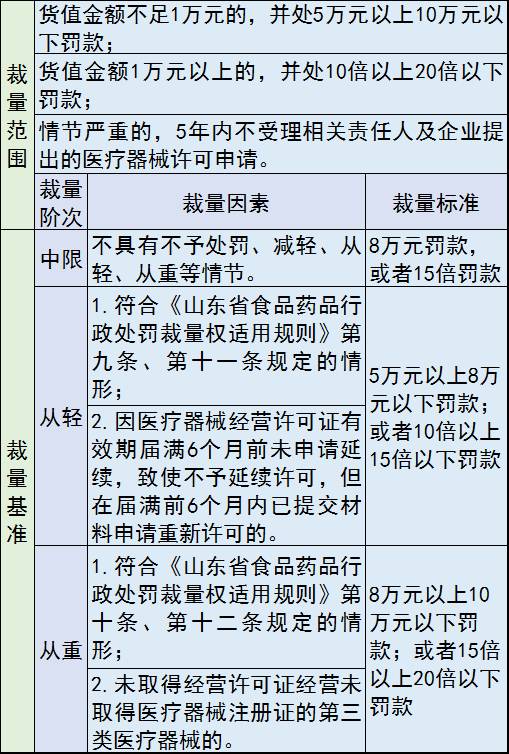
3、未经许可从事第三类医疗器械经营活动
处罚措施包括:没收违法所得、违法生产经营的医疗器械和用于违法生产经营的工具、设备、原材料等物品;并处罚款;情节严重的,5年内不受理相关责任人及企业提出的医疗器械许可申请。
罚款价格表:
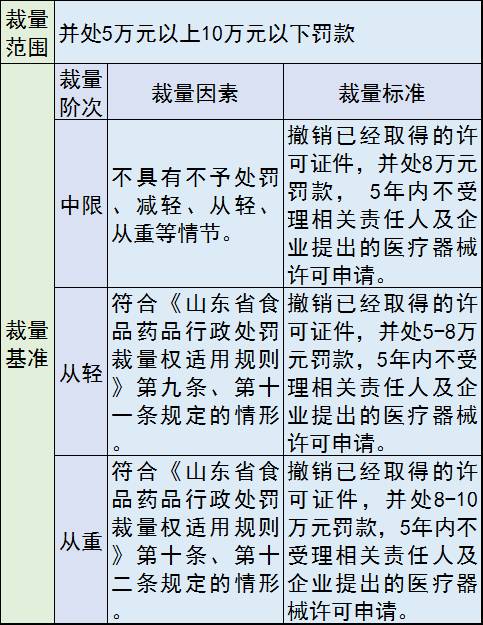
4、提供虚假资料或者采取其他欺骗手段取得医疗器械注册证、医疗器械生产许可证、医疗器械经营许可证、广告批准文件等许可证件的
处罚措施包括:撤销许可证件;并处罚款;5年内不受理相关责任人及企业提出的医疗器械许可申请。
罚款价格表:
5、伪造、变造、买卖、出租、出借相关医疗器械许可证件
处罚包括:收缴或者吊销许可证;没收违法所得;罚款;构成违反治安管理行为的,由公安机关依法予以治安管理处罚。
罚款价格表:
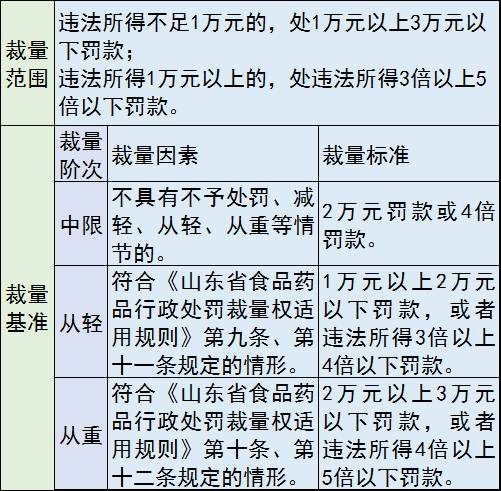
6、未依照《医疗器械监督管理条例》规定备案
处罚措施:罚款
罚款价格表:
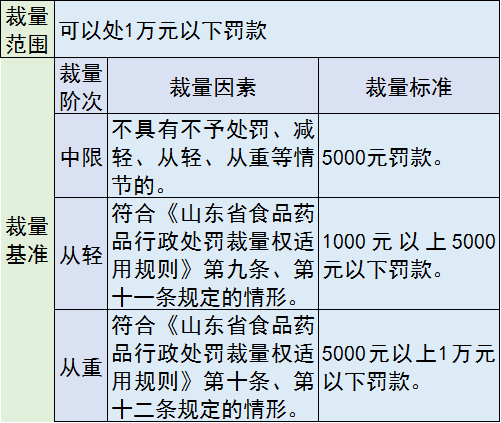
7、备案时提供虚假资料
处罚措施:情节严重的,直接责任人员5年内不得从事医疗器械生产经营活动
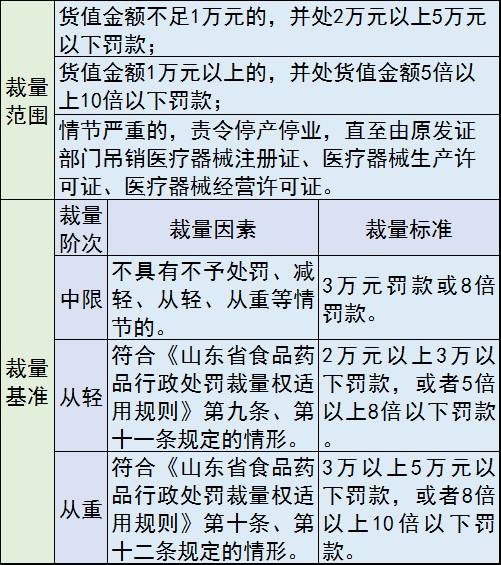
8、五大违法行为,
包括:生产、经营、使用不符合强制性标准或者不符合经注册或者备案的产品技术要求的医疗器械;生产企业未按照经注册或者备案的产品技术要求组织生产,或者未按照规定建立质量管理体系并保持有效运行的;经营、使用无合格证明文件、过期、失效、淘汰的医疗器械,或者使用未依法注册的医疗器械的;药监责令后,仍拒不实施召回或者停止经营医疗器械的;委托不具备规定条件的企业生产医疗器械,或者未对受托方的生产行为进行管理的。
处罚措施包括:没收违法生产、经营或者使用的医疗器械;并处罚款;责令停产停业;吊销医疗器械注册证、医疗器械生产许可证、医疗器械经营许可证。
罚款价格表:
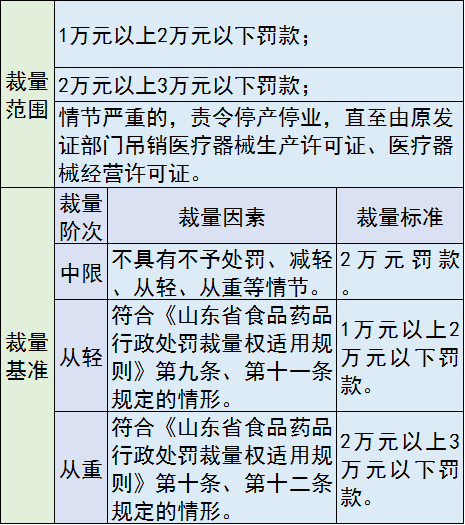
9、四大违法行为
,包括:生产企业的生产条件发生变化、不再符合医疗器械质量管理体系要求,未按照规定整改、停止生产、报告的;生产、经营说明书、标签不符合规定的医疗器械的;未按照说明书和标签标示要求运输、贮存医疗器械的;转让过期、失效、淘汰或者检验不合格的在用医疗器械。
处罚措施包括:罚款;责令停产停业;吊销医疗器械生产许可证、医疗器械经营许可证。
罚款价格表:
10、八大违法行为
,
包括:生产企业未按照要求提交质量管理体系自查报告的;经营企业、使用单位未按照规定建立并执行进货查验记录制度的;第二类、第三类医疗器械批发商以及第三类医疗器械零售商未按照规定建立并执行销售记录制度;对需要定期检查、检验、校准、保养、维护的医疗器械,使用单位未按照产品说明书的要求进行定期检查、检验、校准、保养、维护并记录的;使用单位未妥善保存购入第三类医疗器械的原始资料的;使用单位未按规定建立和保存植入和介入类医疗器械使用记录的;使用单位发现使用的医疗器械存在安全隐患未立即停止使用、通知检修,或者继续使用经检修仍不能达到使用安全标准的医疗器械的;生产经营企业、使用单位未按照规定开展医疗器械不良事件监测,未按照要求报告不良事件,或者对医疗器械不良事件监测技术机构、药监开展的不良事件调查不予配合的。

















