验 证 总 计 划
Validation Master Plan
XXX药业有限公司
制订人:
日期:
审阅人:
|
职 务
|
签 名
|
日 期
|
|
总经理
|
|
|
|
副总经理
|
|
|
|
生产技术部经理
|
|
|
|
质量检验部经理
|
|
|
|
设备安环部经理
|
|
|
|
研究发展部经理
|
|
|
批准人:
1.0 介绍
XXX药业有限公司是一家由中国XXX制药股份公司与XXX科学部合作开办的中外合作企业。
该公司生产XXX原料药及其系列产品。为保证无菌产品的质量,公司严格按照cGMP组织生产,产品质量符合ChP、BP、USP、EP及日抗基等多国药典。为保证产品的质量,我们制定了本计划。
本总计划包括以下部分:工厂组织机构图与部门职责,工厂描述,工艺流程,验证时间计划表等。公司将按照本计划进行验证。
如果系统发生了变更,对变更的部分进行验证。
本验证总计划根据XXX药业有限公司验证管理SOP(QA-G-011)建立。
2.0 文件范围
本计划将描述生产工艺与计划验证的设施。
本计划规定了预计的完成时间及各部门在验证工作中的职责。本计划定义了IQ(安装确认)、OQ(操作确认)、PQ(性能确认)和分析方法验证方案的组成,并提供了IQ、OQ、PQ和分析方法验证的文件样本。
本计划还描述了所有关键区域,描述了附加计划,例如培训、校正、维护保养、清洗与灭菌、环境监测、变更管理、SOP和批生产记录等内容。
3.0 人员与人力
3.1 公司组织结构图
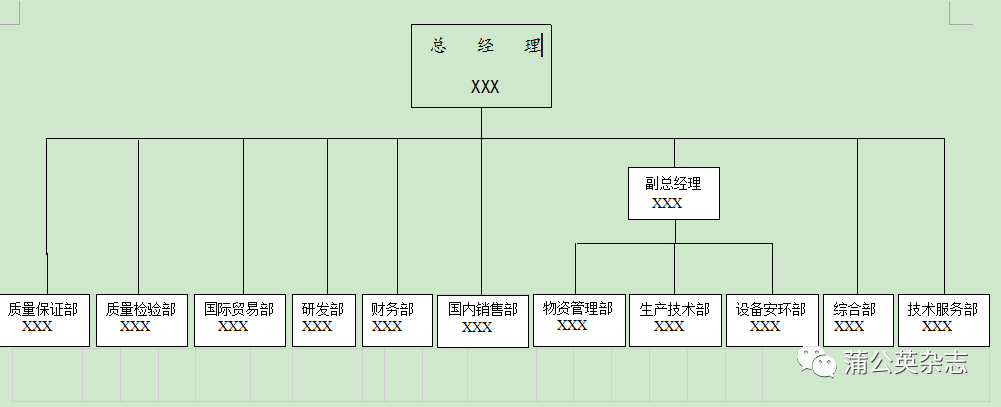
3.2 人员资历
XXX
总经理
职称:高级工程师
教育:华东化工学院
工作经历:1998---- XXX公司,总经理
1994----1998 XXX公司,副总经理兼质量保证部经理
1989----1993 XXX厂华申树脂厂,副厂长
1987----1988 XXX厂联营办
XXX
副总经理
职称:高级工程师
教育:XXX工学院
工作经历:2001---- XXX公司,副总经理
1999----2001 XXX公司,总经理助理兼生产技术部经理
1998-1999 XXX公司,总经理助理兼质量保证部经理
1995----1998 XXX公司,总经理助理
1994----1995 XXX公司,生产技术部经理
1982----1994 XXX石油化工设计院
XXX
质量保证部经理
职称:工程师
教育:XXX工业大学
工作经历:2003---- XXX公司,质量保证部经理
2002----2003,XXX公司,质量保证部副经理
2001----2002,XXX公司,生产技术部副经理
1998----2001,XXX公司,生产技术部
XXX
质量检验部经理
职称:工程师
教育:承德石油高等专科学校
工作经历:2005---- XXX公司,质量检验部经理
2003----2005 XXX公司,质量检验部副经理
1995----2003 XXX公司,质量检验部
XXX
生产技术部经理
职称:工程师
教育:XXX医学院
工作经历:2001---- XXX公司,生产技术部经理
1999----2001 XXX公司,质量保证部经理
XXX
设备安环部经理
职称:工程师
教育:甘肃工业大学
工作经历:2001---- XXX公司,设备安环部经理
1995----2001 XXX公司,生产技术部
1987----1995 XXX市轴承设备厂
XXX
研究发展部经理
职称:工程师
教育:XXX医学院
工作经历:2001---- XXX公司,研究发展部经理
1999----2001 XXX公司,生产技术部副经理
1997----1999 XXX公司,生产技术部工艺员
1992----1997 XXX市第二制药厂
3.3 部门职责
3.3.1 质量保证部
1. 确保公司与产品质量有关的文件、标准、规定、事项与现行GMP一致,与现行药事法规保持一致;
2. 确保公司有一个健全的系统用于执行关键仪器仪表及设备的校验和维护保养及管理;
3. 确保有完整有效地稳定性数据支持产品的标示储存条件和有效期
4. 确保与质量相关的投诉被彻底调查和解决;
5. 确保物料被正确的进行测试并且结果被报告;
6. 确保关键的偏差被调查和解决;
7. 确保有效地执行内审
8. 审核并批准产品处方;
9. 审核并批准所有的标准和生产、检验、物料储存及销售用文件;
10. 审核并批准所有的与产品质量有关的标准操作规程及与之相关的表格;
11. 审核及批准稳定性试验方案及有效期;
12. 审核及批准合同实验室及合同生产商;
13. 审核及批准验证方案及验证报告;
14. 审核及批准对质量有潜在影响的任何变更;
15. 确定各种原辅材料供应商;
16. 审核及批准标签及标示材料的型式;
17. 管理实验批;
18. 审核及批准各部门有关质量事项的报告;
19. 与产品质量相关岗位新员工或转岗员工的上岗资格审查;
20. 组织如SOP等与质量相关文件的年度审查、发放、收回及销毁;
21. 编号系统及批号系统的管理;
22. 公司相关质量文件及记录的管理;
23. 批生产记录及批检验记录、稳定性试验记录的受控发放;
24. 产品标签样张的设计与管理;
25. 批记录及与质量相关的过期文件的销毁处理;
26. 国际注册文件的起草、组织会审、年度变更及报送;
27. 协助公司其它部门进行与质量相关文件的准备;
28. 已批准文件、归档文件的保管;
29. 所有与质量有关的变更的统计、整理及汇总;
30. 所有进厂原材料、包装材料、标示材料、中间体及成品的放行或拒收;
31. 决定退回产品或返工产品的处理方法;
32. 生产过程及实验批的过程监督;
33. 生产、质检、仓储、销售等环节的例行检查;
34. 产品放行入库之前批记录及相关资料的审查;
35. 对产品质量有潜在影响的关键偏差的调查和处理;
36. 对生产区进行环境监测,对环境变化进行趋势分析;
37. 对下述产品进行取样:工艺用水、成品、无菌原辅材料及包装材料和验证样品;
38. 稳定性试验方案的建立和管理、留样审查;
39. 产品质量信息的处理:质量投诉、退换货和产品追回的过程实施及调查处理;
40. 原材料和包装材料的供应商审查;
41. 协调各部门有关产品质量方面的行为;
42. 稳定性数据的汇总分析;
43. 编制产品质量月报、进行产品年度审查;
44. 核算分析质量成本;
45. 收集最新GMP发展等相关技术及质量信息;
46. 追踪并收集国家和省市的有关药事法规;
47. 组织进行GMP自查,对查出的问题制定整改计划,并按计划进行检查、指导及推动改善,结合最新GMP理念,制定公司质量方面的工作计划;
48. 制定公司员工GMP培训计划;
49. 组织召开QA例会和质量分析会;
50. 协助公司各部门接受各种外部质量审查;
51. 负责公司质量管理宣传及全员质量意识的不断提高工作。
3.3.2 生产技术部
1 基本任务
生产技术部是公司负责生产计划、生产调度、工艺管理的部门。在公司主管总经理的直接领导下,负责执行根据公司方针目标编制的年度生产计划及季、月度作业计划,并对计划执行情况进行统计分析;负责工艺管理、常规技措管理;贯彻执行国家及上级有关安全生产的方针、政策、法规和指示。按公司培训计划对员工进行安全教育,定期组织安全检查,编制安措并付诸实施。
2 职责范围
2.1 计划统计
2.1.1 负责年、季、月综合生产计划的下达、调整,负责月度统计报表的综合分析。
2.1.2 负责生产调度工作,按照月度计划的各项具体要求,组织、协调、调度公司的生产过程,确保月度作业计划和季度、年度作业计划的完成。
2.1.3 负责生产统计分析及月、季、年报工作。
2.2 生产管理
2.2.1负责公司各产品的生产管理工作。组织生产,进行产品质量、现场管理、GMP实施等工作,确保本部门方针目标的完成。
2.2.2负责控制各品种的生产成本。
2.2.3负责本部门现场管理水平的维持和不断提高。现场管理的标准制定、督促检查工作。
2.2.4 负责本部门QC小组、班组管理及合理化建设活动的开展及成果评价。
2.3 工艺技术管理
2.3.1 负责贯彻GMP中有关生产、工艺部分的工作,保持、提高生产系统的GMP管理水平。组织对生产过程中发生的常见工艺问题进行分析,并配合相关部门进行质量问题的分析和改进措施的实施。
2.3.2 负责各品种产品技术经济指标信息的收集、分析、交流等。
2.3.3 负责公司内全部具有成熟工艺的产品生产技术,负责组织对工艺纪律的检查和考核。
2.3.4 负责组织公司技术攻关项目的具体实施与总结。
2.3.5 负责公司生产技术方面合理化建议的落实。
3.3.3 设备安环部
1. 基本任务
设备安环部是公司负责设备、动力、计量管理的部门,在公司总经理的领导下,负责公司设备、动力、计量、安全和工程施工的管理,保证设备正常运行,保证公司生产、生活的动力供应,贯彻执行国家计量法规,做好公司仪器、仪表的计量工作,负责公司施工管理,保证施工进度和质量。
2. 职责范围
2.1设备管理
2.1.1 对设备的配置、选型、采购、进厂检验、安装、使用维护、检修、调迁、更新、改造、报废进行全过程管理。负责设备检修及维护保养计划的编制及组织实施。
2.1.2 负责制订设备的各项规章制度,建立设备台帐。
2.1.3 负责主要设备备品备件的管理。
2.1.4 负责压力容器及起重设备的管理。
2.1.5 负责设备事故的管理。
2.1.6 负责设备年度审查。
2.2 能源管理.
2.2.1负责公司的动力管理,确保水、电、汽、压缩空气、制冷、真空的正常供应。
2.2.2 负责制定主要耗能环节和重点耗能设备的合理用能标准。公司有关部门逐步进行技术改造,降低能耗,提高能源利用率。
2.2.3负责能源的计量工作。
2.3 计量管理
2.3.1 负责有关计量法规的宣传、贯彻执行,按要求开展计量工作。
2.3.2 负责组织编制仪器、仪表等计量器具、自控装置系统的大修更新计划。
2.3.3 负责组织编制公司最高级计量标准器的送检计划,强检计量器具的周检计划和一般计量器具的周检计划。
2.3.4 负责对公司仪器仪表的选型、到货验收、周期检定、报废全过程的统一管理,并参与购置。
2.4 施工管理
2.4.1 负责公司工程施工的进度、施工质量和工程验收。
2.4.2 负责公司工程施工的预算和结算的管理。
2.4.3 负责公司的厂房设施的完好,及时进行维护。
2.5 安全环保管理
3.3.4 质量检验部
1. 组织机构:
质量检验部负责公司的质量检验工作,下设两个组:理化检验组和微生物检验组。
2. 职责:
2.1 质量检验部职责
2.1.1负责组织制订和修订原材料、包装材料、产品内控标准和检验规程并进行实施,按内控标准对成品进行检验并出具检验报告。
2.1.2负责进厂原材料、包装材料抽样与检验,工艺用水检验,并出具检验报告。
2.1.3负责中间控制样品的检测
2.1.4负责新检验方法的试验及实施。
2.1.5负责对厂外实验室的审查及委托检验合同的签定。
2.1.6协助有关部门进行工艺规程有关产品质量部分的编制,对本公司所用原、辅材料、包装材料、工艺用水的质量标准进行起草,协助有关部门进行原、辅材料、包装材料供应商审核的检测工作。
2.1.7参与本公司GMP实施工作的检查。
2.1.8参与有关部门组织的用户走访活动。
2.1.9参与有关检验方法、生产工艺的验证工作。
2.2 理化组负责公司成品、原材料、包装材料、工艺用水理化指标的检验。
2.2.1负责稳定性实验样品、用户投诉样品的检验。
2.2.2参与质量标准及有关SOP的起草、审核工作。
2.2.3负责方法验证及公司生产设备及工艺验证的有关检验工作。
2.2.4负责工作标准品(标准溶液)的制备、标定及管理。
2.2.5负责原材料留样。
2.3 微生物组
2.3.1负责公司产品、无菌原材料的无菌检验工作。
2.3.2负责公司验证有关微生物方面的检验工作。
2.4中间体控制组
2.4.1负责中间控制样品的检测工作并出具检验报告。
2.4.2负责中间控制检验方法的新方法的试验及验证工作,参与公司有关验证工作。
4.0 工厂描述
4.1 工厂描述
XXX药业有限公司坐落于XXX省XXX经济技术开发区兴业街8号。厂区内有生产车间、溶媒回收区、QC实验室、办公大楼、仓库、车库、餐厅及其他辅助区。平面图附后。
4.2 生产区描述
生产车间用于生产XXX原料药及其系列产品。操作分两班进行。生产车间为三层。第三层有溶液配制、除菌过滤和结晶,还有质量检验部中间体控制岗位,其中除菌过滤和结晶操作在10,000级洁净区进行,结晶时有100级层流空气的保护,溶液配制在100,000级洁净区进行。第二层有洗涤、制水和空调岗位,其中洗涤在10,000级区进行,有100级层流空气的保护。第一层有干燥、磨粉、混粉、分装和准备操作,均在10,000级区进行,其中磨粉和分装有100级层流空气的保护。
4.3 其他建筑与配合区描述
4.3.1 质量检验部/办公大楼
质量检验部/办公大楼是一座2层建筑,位于生产车间的东北方。包括化学和微生物实验室、质量保证部和其他部门的办公室等。
4.3.2 车库和餐厅
车库和餐厅是一座2层建筑,位于厂区的西北角方向。该建筑包括一个车库、一个餐厅和综合库。
4.3.3 仓库
仓库是一个1层建筑,高7米,位于工厂的西南角。分为原材料库、成品库、包材库。
4.3.4 溶媒回收
溶媒回收车间是一座3层建筑,位于生产车间的西面,包括回收设备和容器及办公室,其中第一层为开放性建筑。
5.0 人员和物料流程图
见附图。
6.0 工艺描述
XXX药业有限公司生产XXX原料药及其系列产品。
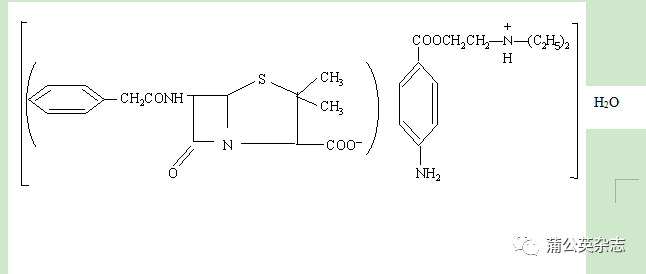
XXX为β-内酰胺类抗生素,化学名称为:对氨基苯甲酰基2-(二乙氨基)乙酯(6R)-6-(乙苯基乙酰)氨基-青霉烷酸盐一水合物。其分子式是C16H18N2O4S·C13H20N2O2·H2O。分子量为588.72。该产品为白色结晶性粉末,遇酸、碱XXX酶及某些金属离子(铜、铅、汞和银)易发生分子重排,导致β-内酰胺环的破裂而失去抗菌活性。易溶于甲醇,在乙醇或和氯仿中略溶,微溶于水。为了增加其在水中的溶解性,可以加入卵磷脂或聚山梨酯80等作为分散剂。
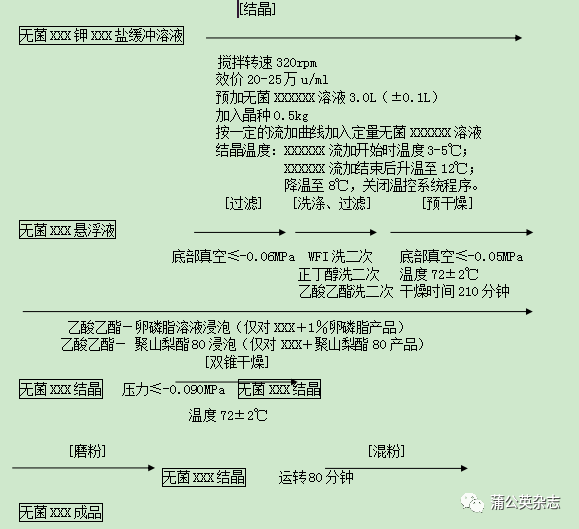
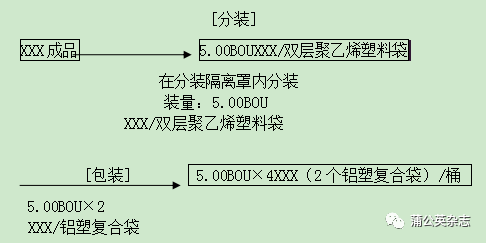
XXX的生产工艺所包括的步骤为:溶液配制、溶液过滤、结晶、过滤、洗涤、预干燥、真空干燥、磨粉、混粉、分装和包装。
XXX的结构式:
6.1工艺流程图(XXX、XXX+1%卵磷脂、XXX+聚山梨酯80)
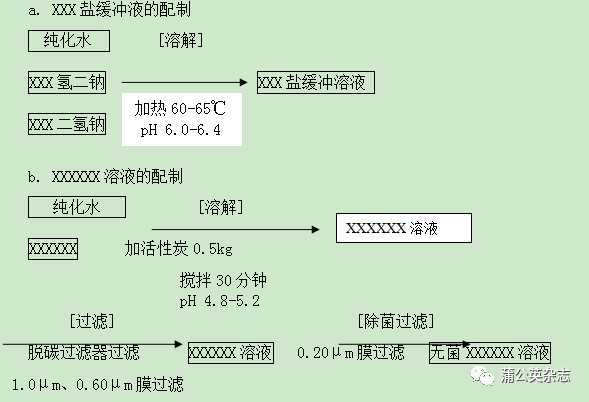
6.1.1 溶液配制
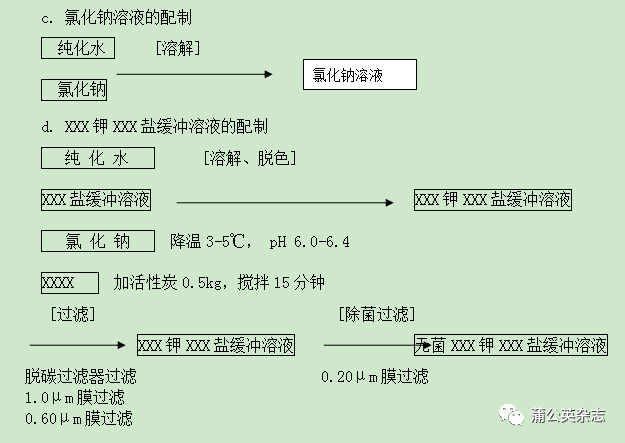
6.1.2 结晶、过滤(洗涤、过滤、预干燥)、干燥、磨粉、混粉
6 .1.3 包装
7.0 验证步骤
7.1 介绍
验证的目的是证明设备、辅助设施和工艺符合预定的接受标准,并且具有重现性。
验证计划应符合公司的标准、规范和规格以及cGMP要求。在执行之前生产技术部、质量检验部、设备安环部和质量保证部应审阅并批准所有的验证方案。同样在执行完成之后,这些部门应审阅并批准已完成的方案。质量保证部经理对这些方案的建立、执行和总结进行最终批准。
7.2 步骤
验证工作是实施GMP的一部分,涉及工程、生产、检验和质量管理的各环节,应将各部门协调起来一起进行。验证的步骤为:制定验证总计划、制定标准操作规程、制定验证方案,实施验证并按顺序进行。
7.3 方案的建立与描述
在验证工作开展之前,所有与验证有关的仪器仪表必须经过校正,且最好在校验有效期的前半部分,验证按如下顺序进行:检验方法验证→系统(设备)IQ
→
系统(设备)OQ
→
系统(设备)PQ
→
生产工艺验证
→
无菌工艺验证;各系统验证的先后顺序为:公用工程系统(IQ、OQ、PQ)
→
生产系统(IQ、OQ、PQ)。每个系统验证完成之后应有一个最终报告,描述该系统的验证情况。
所有含量测定的方法均要经过验证,其它测定方法可以根据实际情况确定。验证完成之后应有一个最终报告,描述该系统的验证情况。
7.3.1 安装确认
IQ方案是对设备或系统的静态特性做全面检查。安装过程中或完成后,对系统或设备的设计和安全因素进行详细的评价,以确认该系统是根据图纸和说明书安装的,并且公用设施(水、蒸气、电等等)和设备连接正确,同时IQ对该设备的材质和工作能力进行评价。
IQ执行过程中出现的偏差应在方案中注明。对于影响工艺或产品质量的偏差应进行
调查、审阅以做判断、更正,必要时做再验证。所有的数据应归档。对于经评估后认为不影响产品质量但与设计图纸不一致的,应进行说明。
7.3.2 操作确认
在成功完成IQ之后,应执行OQ。
OQ的执行应至少连续3次得到一致的结果。确认系统的操作参数如压力、温度、电压、流速、转速等以及系统的连锁警报装置的功能,应有挑战性测试以挑战系统的能力。对SOP的操作性、效果进行验证。
OQ文件中还应列出所有操作、维护、安全、清洗等已被批准的SOP。
OQ执行过程中出现的偏差应在方案中注明。对于影响工艺或产品质量的偏差应进
行调查、审阅以做判断、更正,必要时对SOP进行修订,之后对系统进行再确认。所有的数据应归档。
7.3.3 性能确认
IQ和OQ成功地完成之后进行PQ。
PQ用于测试性能或关键工艺参数。
为测定系统或工艺的能力以达到可重现结果,应至少进行3次研究。
PQ执行过程中出现的偏差应在方案中注明。对于影响工艺或产品质量的偏差应进行
调查、审阅以做判断、更正,必要时做再确认。所有的数据应归档。
7.3.4 分析方法验证
新购买的分析仪器应进行IQ、OQ和PQ确认。这些确认由我公司和供应商共同完成。
分析方法验证是对某一分析方法做全面的评价。分析方法验证主要考察准确度、精密度、专属性、检测限、定量限、线性与范围和耐用性。不同类型的分析方法需要提供不同的验证信息。含量测定的验证包括准确度、精密度、专属性、线性范围和耐用性。杂质定量测定的验证包括准确度、精密度、专属性、定量限、线性范围和耐用性。
杂质限度的测定包括准确度、专属性、检测限和耐用性。鉴别方法验证包括专属性和耐用性。
方法验证执行过程中出现的偏差应在方案中注明并进行调查、审阅以做判断、更正,必要时做再验证。所有的数据应归档。
7.4 培训
在执行每个验证方案之前,应由方案起草人员组织对该方案的执行人员或其他相关人员进行培训工作,以便相关人员正确理解方案所有内容,从而确保该方案的顺利实施与完成。该培训记录附于方案之后。
7.5 方案清单
下表列出了应进行验证的系统。
|
验证名称
|
IQ
|
OQ
|
PQ
|
|
工艺设备和系统
电热烘箱[X105]
蒸汽消毒柜[X106]
蒸汽消毒柜[X184]
无菌工艺验证
XXX+1%卵磷脂产品回溯性验证
|
-
-
-
-
-
|
-
|





