哺乳类基因组中绝大多数CG中的胞嘧啶C都会发生5位甲基化(5mC)。DNA 5mC参与转录沉默和基因印记等重要生物学过程,其催化酶有DNMT1,DNMT3A以及DNMT3B。DNA甲基化的准确调控与机体发育有着密切的关系,因此其建立和维持也是表观遗传领域的关键问题。此前,Baubec, T发表在2015年《Nature》的研究
Genomic profiling of DNA methyltransferases reveals a role for DNMT3B in genic methylation
发现组蛋白H3K36三甲基化(H3K36me3)招募DNMT3B在基因转录区建立DNA 5mC甲基化,但是
基因间区的
DNA
甲基化是如何建立与维持的呢
?
2019年9月4日,来自哥伦比亚大学欧文医疗中心的路超教授,洛克菲勒大学的C. David Allis教授和麦吉尔大学的Jacek Majewski教授带领的研究团队在Nature上在线发表题为
The histone mark H3K36me2 recruits DNMT3A and shapes the intergenic DNA methylation landscape
的文章,发现
NSD1
介导的
H3K36me2
,对于基因间区
DNMT3A
的招募以及
DNA
甲基化的维持是重要的
,
解开了上述的疑问。

在针对C3H10T1/2小鼠骨髓间充质干细胞的表观谱研究中,研究者意外地观察到DNMT3A/3B、DNA甲基化以及组蛋白H3K36me2/3的分布高度重叠(图1a和1b)。但与基因区不同的是,DNMT3A在基因间区与H3K36me2的相关性更好,似乎可能扮演更重要的角色(图1a,对比3个阴影区)。
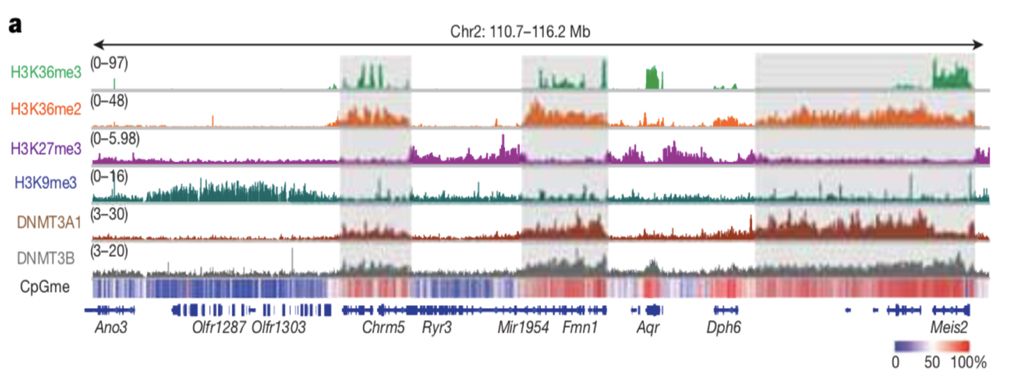
图
1a. H3K36me3
、
H3K36me2
与
DNMT3A
、
DNMT3B
以及
CpG
甲基化在基因组上的分布位置高度拟合
;
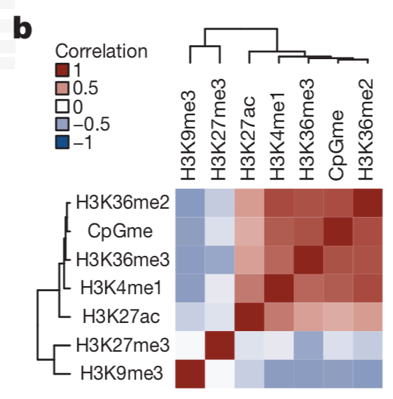
图
1b.
各类表观修饰水平相关性分析
:
CpG
甲基化与
H3K36me2
、
H3K36me3
正相关性较强,与
H3K27ac
、
H3K27me3
、
H3K9me3
显著正相关性
通过体外实验,研究人员进一步阐明了
DNMT3A
的
PWWP
阅读器对于
H3K36me2
有着更强的结合
(此前领域中认为其只是H3K36me3的阅读器)。不同的是,DNMT3B对H3K36me3的亲和力最强,H3K36me2次之。因此,一个小小的甲基化的区别,就导致了基因组的分区,以及不同分区中的DNA甲基化的建立方式。具体的,
DNMT pwwp结构域对H3K36me2和H3K36me3的优先结合指导了DNMT3A/3B在染色质中的定位,且H3K36me2和H3K36me3的比率是决定DNMT3A在染色质上分布模式的关键因素,也在较小程度上指导了DNMT3B的分布。
这个发现也暗示着
DNMT3A
和
3B
与组蛋白
H3K36me2
和
me3
在进化中,可能存在着共同演化的关系。目的是为了完成基因区和基因间区的划分,并同时维持两大区间内的
DNA
甲基化。
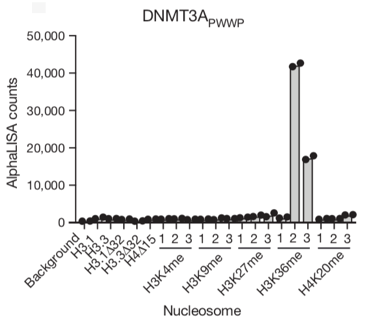
图
2. DNMT3Apwwp
结构域对不同修饰的组蛋白的亲和力实验:
DNMT3Apwwp
对
H3K36me2
的亲和力最高,
H3K36me3
次之,不与其它修饰的组蛋白结合
那么这个调控重要吗?
研究者在3类人类疾病,TBRS,Sotos综合症和HNSCC(详见下),中证明了H3K36me2催化酶NSD1的缺失或是DNMT3A PWWP的突变,会导致基因间区H3K36me2和DNA 5mC显著下降,引发疾病表型。这些发现也提示,在未来针对这些疾病的治疗方案中,需要考虑到NSD1以及DNMT3A的失活以设计靶向性药物修复表观遗传稳态。
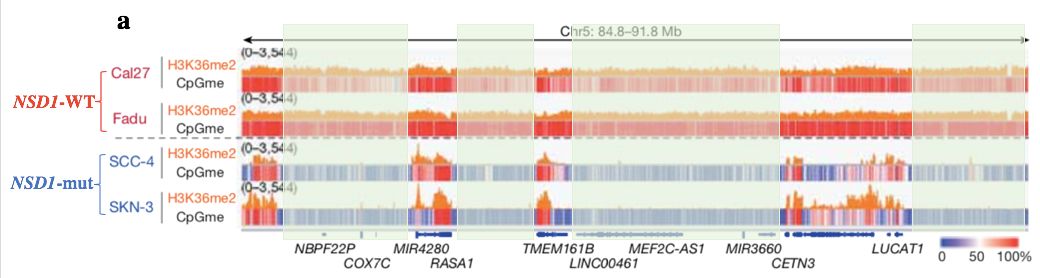
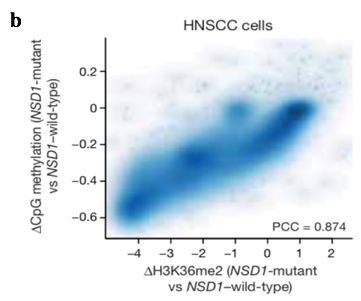
图
3a. HNSCC
细胞系基因组(
Chr5: 84.8–91.8 Mb
)
ChIP-seq
图谱:
由
NSD1
突变引起的
H3K36me2
缺失伴随着相应位置
CpG
低甲基化);
图
3b. HNSCC
细胞系中
H3K36me2
的水平与
CpG
甲基化水平呈线性正相关
本研究完善了本领域对于
DNA
甲基化建立和维持的认知:
现在我们知道了DNMT3A和DNMT3B在其PWWP结构域的指导下分别优先靶向富含H3K36me2的基因间区域和富含H3K36me3的基因内部区域。此外,在活性启动子区域,CpG岛通过CXXC阅读器招募TETs、KDM2B以及CFP-Set1a/b复合物,以建立低DNA甲基化、低H3K36me2以及高H3K4me3的染色质环境,从而保护启动子区免于异常甲基化。总的来说,他们提出以下观点:
DNMT3A
和
DNMT3B
联合发挥作用在广泛的常染色区域建立
CpG
甲基化,而转录起始位点则通过另一套机制抑制
DNA
甲基化。
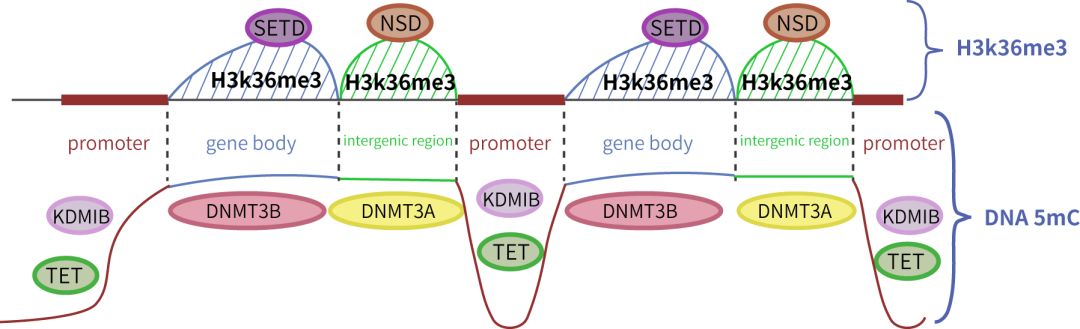
常染色体基因组甲基化建立模式图
(点击查看大图)
路超博士2007年获新加坡国立大学生物学学士学位,2013年获美国宾夕法尼亚大学医学院博士学位。同年进入美国洛克菲勒大学染色质生物学和表观遗传学实验室,师从美国著名表观遗传学家C. Davids Allis进行博士后研究。2016年在人类未分化的肉瘤中首次鉴定了H3.1中的新型突变——K36M/I,该突变会抑制H3K36甲基转移酶的活性,导致H3K36甲基化丧失,引起全基因组H3K27甲基化的增加。增加的H3K27甲基化又会导致polycomb抑制复合物I的重新分配,从而抑制能够阻断间叶细胞分化的基因的表达,该项工作发表于《Science》。目前路超博士于哥伦比亚大学任职。
TBRS
(Tatton–Brown–Rahman syndrome ) 是一种儿童期过度生长综合征,存在DNMT3A错义突变,而90%的
Sotos综合症
患者都存在NSD1突变。两者在临床表现上有很多相似之处,例如骨骼过度生长,面部畸形和智力障碍。而本研究成果提示相似的疾病表型是由相关的分子机制所介导的。而
HNSCC
(neck squamous cell carcinomas)颈部鳞状细胞癌,是一类恶性癌症,其中部分患者携带有NSD1失活突变。















