
本文为投稿文章,投稿请发送至 [email protected],谢谢!
美国的专利制度与中国存在诸多不同,在药品领域,从保护客体、保护期限到专利链接,都有其独特之处。
针对药品领域的可授权客体,美国专利制度与中国专利制度的最大不同就在于疾病的诊断和治疗方法。我国明确规定疾病的诊断和治疗方法不属于可授予专利权的客体,而在美国,疾病的诊断和治疗方法可以获得专利保护。因此,国内的药企在美国申请专利的时候,就需要注意权利要求的撰写方式。
举例说明如下:
来那度胺
美国已授权专利US7189740 B2权1如下,保护了来那度胺治疗骨髓增生异常综合征MDS的方法:

而中国同族专利CN1713917B 权1如下,保护的则是来那度胺的制药用途:
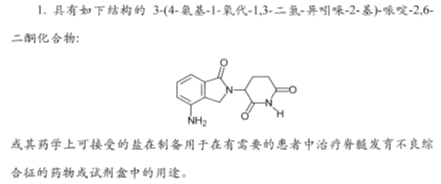
(1)适用对象
根据美国专利法35USC 156条的规定,PTE制度的适用对象为
药品
(包括人用药品和兽用药品)、
医疗器械、食品添加剂、颜料添加剂
。相关专利可以是产品专利、使用方法专利或者制备方法专利。
(2)申请条件
申请延长专利期需满足以下条件:(1)专利未过期;(2)专利以前未依据本条获得过延期;(3)由专利权人或其代理人提出申请;(4)产品在上市前经过监管审查期(regulatory review period);(5)该产品是经过监管审查期后首个被批准上市的产品;(6)申请人需在产品获批准后60天内向USPTO递交专利期限延长申请。同一个产品仅能有一项专利获得延期。
(3)延长期限的计算
药品专利权延长期限的计算为临床研究时间的一半加上新药审批时间,但如果是申请人自己的过失导致专利期限耽搁的,则延长期将被缩短。专利权期限是否能够获得延期以及具体延期天数在专利权人提出申请后由USPTO决定。最多可延长5年,并且自产品上市之日起,专利保护剩余期限加上PTE期限最多不得超过14年。
(4)查询方法
在美国商标专利局(USPTO)的官网上公开了在35 USC 156条款下获得专利期限延长的品种(Patent TermsExtended Under 35 USC §156)。比如抗癫痫药物卢非酰胺的化合物专利US6740669B延长了819天至2022.11.14,抗癌药物达沙替尼的化合物专利US6596746B延长了76天至2020.6.28,抗真菌药物阿尼芬净的化合物专利US5965525B 延长了1223天至2020.2.17。
除了上述网站外,通过USPTO的Public PAIR也可以查询到某一专利的PTE情况。
除PTE制度外,美国还有专利期限调整(Patent Term Adjustment,PTA)制度,该制度并不局限于药品专利,而是针对任何专利,在专利申请、审查、授权程序中,由于USPTO或非申请人原因造成延迟的,USPTO须将拖延的天数补偿至专利期限中。关于PTA情况,可以通过USPTO的PublicPAIR或者专利说明书扉页获取。比如瑞戈非尼的化合物专利US8637553B通过PTA途径获得了2400天的专利期限延长。
(1)收录专利类型
橙皮书制度是美国药品专利链接制度的内容之一,新药注册时新药申请人必须向FDA提交专利信息。根据21 CFR §314.53的规定,须提交相关信息的专利包括以下类型:
原料药(即活性成分)、晶型、制剂及用法专利
。对于多晶型专利而言,申请人还需提供实验数据证明含有这种多晶型的药品与新药申请中所述药品具有生物等效性。
(2)不予收录专利类型
根据21 CFR §314.53的规定,
工艺、包装、代谢物
和
中间体
专利的信息申请人无需提交给FDA。
(3)专利信息提交时机
申请人向FDA提交专利信息的时机包括
提交新药申请或补充申请时、新药批准后
。在新药申请或补充申请时提交专利信息使用的表格为Form 3542a;在新药申请或补充申请获得批准后30天内,申请人应再提交包含原料药(活性成分)、制剂或批准用法专利的每个专利的表格 Form 3542。只有Form 3542 中的专利信息才会在橙皮书中公开。对于在新药申请批准日期后才获得授权的专利,申请人应在专利授权日后30天内将专利信息提交FDA,此时使用表格为Form 3542。
(4)专利信息错误更正
根据21CFR § 314.53的规定,如果任何人对橙皮书中所列专利信息的正确性或相关度存有异议,或认为申请人未能提交所需专利信息,均可以向FDA提出书面通知,阐述对专利信息存在异议的原因。FDA收到通知后将要求新药申请人确认专利信息是否应更正或撤回。但除非新药申请人更正或撤回,否则FDA不会主动进行更改。原因在于FDA对于申请人提交的专利信息仅进行形式审查,而对其是否符合法规要求并无实质审查的责任。
(1)ANDA与专利声明
除橙皮书制度外,美国药品专利链接制度的另一内容则是ANDA制度,FDA根据ANDA提交时的专利声明情况采取不同的后续审批程序。
根据21USC 355(j)条款的规定,仿制药申请人在提交ANDA时,需同时提交参照上市药品在橙皮书中收录的每一个专利的声明,包括以下四种情况:
Paragraph I(第I段声明):没有专利登记信息;
Paragraph II(第II段声明):专利保护期已届满;
Paragraph III(第III段声明):专利即将过期;
Paragraph IV(第IV段声明):专利是无效的或者申请人在生产、使用、销售所申报的药品时不会侵犯该专利。
对于第I、II段声明的ANDA,如果满足其他条件,FDA可直接批准;对于第III段声明,FDA可以给予暂时批准(tentativeapproval),待专利保护期限届满后发给最终批准(final approval);第IV段声明,即所谓的专利挑战。
(2)专利挑战
仿制药申请人提出第IV段声明时,有义务在ANDA申请获得FDA接受后的20天内通知原研药厂商和/或专利权人。原研药厂商或专利权人接到通知后45天内可以选择向法院提出专利侵权诉讼。如果原研药厂商或专利权人不起诉,FDA可随时批准ANDA。而如果一旦专利侵权诉讼提出后,则FDA的审批程序进入30个月遏制期(起算时间为原研药厂商或专利权人接到通知之日)。30个月遏制期满后,FDA批准仿制药;在30个月以内,如果法院判决专利无效或仿制药不侵犯专利权,则FDA会批准仿制药并且第一个提出申请的仿制药厂商获得180天市场独占期(起算点为FDA批准上市后的销售首日)。
查询方法:
a. 查询有哪些仿制药申请提出了ParagraphIV 声明可通过以下网站:
FDA官网:Paragraph IV PatentCertifications
该网页提供了专利挑战药品的名称、剂型、规格以及ANDA申请提交时间;每个月更新2次;可下载pdf格式。
b. 查询ANDA申请挑战的具体哪篇专利可通过以下网站:
Robins Kaplan:GENERICally SpeakingHatch-Waxman Bulletin
Hatch-Waxman公报每个季度更新一次,记载了被专利挑战的药品商品名、专利号以及原被告双方。
(3)小八条声明
根据21USC 355(j)条款的规定,对于橙皮书中的使用方法专利,仿制药厂商还可以提出“Little viii statement”,俗称“小八条声明”,即声明仿制药所申报的适应症不包含于使用方法专利所保护范围内。前提是该药品具有至少两个适应症并且至少一个适应症不受专利保护。小八条声明不涉及专利侵权,故只要符合其它条件,FDA审查完后会立即批准。对于仅含小八条声明的ANDA申请,仿制药厂商并不会获得180天市场独占权。
(4)国内药企在美专利挑战情况
国内一些研发实力较强的药企已经在积极地加入了在美专利挑战的行列,以华海和东阳光为例,目前已检索到华海药业提出paragraph IV 申明的ANDA包括
托法替布、替格瑞洛、阿立哌唑、达比加群酯、芬戈莫德、米拉贝隆和帕罗西汀
等品种,其中帕罗西汀已经在一审法院胜诉。东阳光药提出专利挑战的ANDA包括替格瑞洛、利格列汀、利格列汀/二甲双胍复方、芬戈莫德、埃索美拉唑等品种。
中国仿制药企走出国门,如何突破重围?
想蹭“专利悬崖”,怎样应对原研药巨头的专利阻击?
100页
《中国仿制药白皮书》
给你全面解答:
下载白皮书电子版,点击文末【
阅读原文
】
智慧芽最新产品Chemical化学数据库上线啦!现开通了免费试用,你不想来体验下吗?
-
1.4亿化学结构式
-
专利、药品、反应、高分子、临床等多维度数据
-
首创3D形式,展示分子结构相似性
长按识别二维码 立即
开启试用

☟ ☟ ☟点击【阅读原文】可下载《仿制药白皮书》





