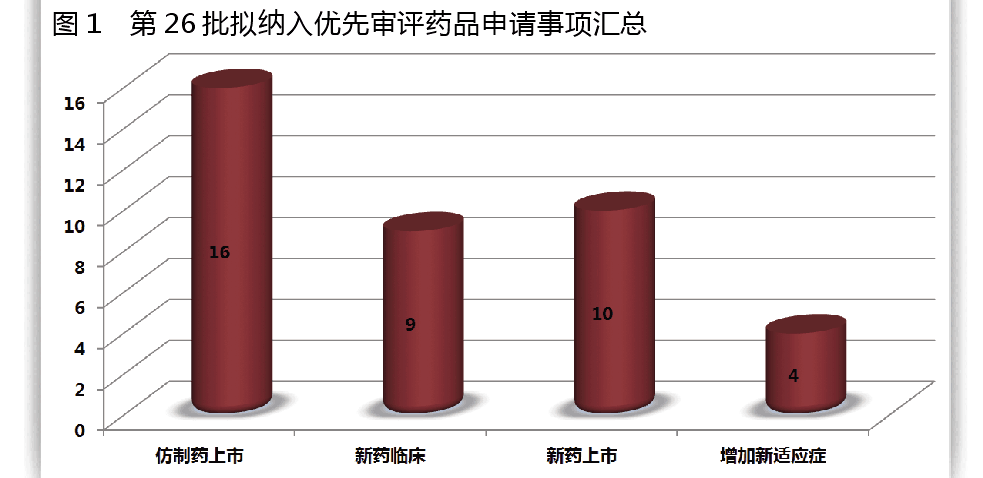
CFDA药品审评中心发布的《拟纳入优先审评程序药品注册申请的公示(第二十六批)》,将39个拟优先审评的药品注册申请及其申请人予以公示。据公示名单,此次入选的39个药品中,16个药品为仿制药上市,9个药品为新药临床,10个为新药上市,4个为增加新适应症。
在第二十六批优先审评名单中,入选的三款CAR-T细胞药物是:上海恒润达生、科济生物和银河生物的3个CAR-T疗法的临床申请。纳入理由是:使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请。
细胞治疗技术是目前国际医学前沿重点发展的领域,它给一些人类疑难疾病的治疗提供了新希望。近年来,细胞治疗领域不断取得新的研究成果,细胞治疗产品的研发与评价也日益受到国内外制药企业及各国政府的高度关注。2017年12月22日,CFDA发布《细胞治疗产品研究与评价技术指导原则(试行)》,整个细胞治疗领域将迎来规范化发展,发展速度也将大大提升,国内CAR-T细胞药物申报快速跟进国外研发速度,市场前景值得期待。
国内细胞治疗研发紧跟美国步伐,目前已有6家公司的临床申请获得受理,除此次纳入优先审评公示名单的3家公司之外,还有:2017年12月18日南京传奇生物的CAR-T细胞自体回输制剂被纳入第25批优先审评名单;2018年1月8日博生吉安科细胞技术公司的CD19T细胞注射剂;2018年1月12日上海名聚生物的JWCAR029已进行申报。
目前,全球共有两个CAR-T产品获批上市,分别是诺华的Kymriah(tisagenlecleucel)和Kite制药的Yescarta(KTE-C19)。Kymriah获批用于治疗儿童和年轻成人(2~25岁)的急性淋巴细胞白血病(ALL),年费用47.5万美元;Yescarta获批用于治疗特定类型大B细胞淋巴瘤,年费用37.3万美元。有专家预测,我国首个自主研发的CAR-T疗法药物有望在3年内获批,而年费用也会降到人们可承受的范围内,甚至是10万元以内。
复星医药利妥昔单抗注射液上市申请被纳入优先审评公示名单,意味着首个国产生物类似药上市进入最后冲刺阶段。
利妥昔单抗由罗氏旗下基因泰克开发,1997年11月获准在美国上市,商品名为“Rituxan”。1998年6月2日获得欧洲EMA批准;2001年6月20日获得日本PMDA批准;2008年4月21日获CFDA批准上市,并由百健和罗氏在美国、欧洲、日本和中国市场销售。该产品主要用于非霍奇金淋巴瘤和淋巴细胞白血病的治疗,为全球首个获批的CD20类单抗。该药是罗氏公司的主打品种,印度、俄罗斯和拉丁美洲几个国家市场已经有几种仿制产品。
据全球畅销药数据统计,2016年利妥昔单抗销售额为74.1亿美元,同比增长1%。2005-2016年该产品年复合增长率为7.5%。2007年该药全球销售额突破50亿美元,2013-2016年连续4年全球销售额突破70亿美元。该药欧盟专利在2015年失效,并将于2018年在美国专利期满。
据样本医院数据统计,利妥昔单抗2016年用药金额为9.8亿元,较同期增长23.5%,2005-2016年年复合增长率为28.1%。该产品自2012年起样本医院用药金额过5亿元,在国内样本医院抗体药物领域销售额排名第一。在国内市场刚性需求拉动下,继续表现出强劲的增长态势。
利妥昔单抗由罗氏于2000年获批在国内上市,商品名为“美罗华”,剂型为注射液,规格有500mg:50ml和100mg:10ml两种。该产品是非霍奇金氏淋巴瘤的“金标准”治疗药物,并作为晚期结肠癌的一线用药。
目前国内正在申报利妥昔单抗的企业有复宏汉霖、正大天晴、华兰基因、神州细胞、信达生物、浙江海正等。利妥昔单抗是复星医药第一个大分子单抗药物,也是国内首个生物类似药。复星医药的子公司复宏汉霖利妥昔生物类似药累计研发投入超过3亿元,预计将在2018年内获批。据专业人士预测,该产品上市后市场潜力巨大,年销售额有望超过30亿元。目前复星医药大分子单抗药物布局齐全,类似药系列处于国内前列,后续产品梯队较为丰富。