正文
面临不断变化的环境,越来越多的中国制药企业紧密关注全球监管政策和商业环境的变化。立足本土,开拓国际市场,通过制定清晰的国际化战略实现新的增长机会已经成为行业关注的热点话题之一。CPhI China 2017召开之际,科睿唯安将推出国际化拓展方向系列文章、线上活动及CPhI现场报告,期待能为业内同仁带来思考和帮助!
全球仿制药、生物类似药和原料药生产商展望:趋势、机遇与挑战
原文作者:Mike Chace-Ortiz, CEng
全球制药市场持续变化,最主要的表现在于仿制药的市场份额和数量持续上升。当前,全球研发支出增长趋缓,监管日趋严格,使用者付费不断增加,产业整合再度升温,生产商应该如何应对这些问题?本文通过分析制药行业成功的增长模型及案例,探讨专业信息如何帮助企业快速而有效地向更高价值的产品和服务转化?以及正在经历变革的行业和企业,他们新的、不同以往的战略需要哪些信息来满足不断变化的需求?
目前,全球每年用于提供国民医疗保障的药费超过1万亿美元。预计到2018年,这笔花费将以平均每年5.5%速度递增,但是不同区域增速有明显不同。多数欧洲市场的增速小于2%,而很多亚洲、中东、拉美和非洲国家的增速将超过8%。
现在,全球仿制药市场规模约为4350亿美元,预计到2017年,市场份额将增长至36%。虽然仿制药已达到很高的市场渗透率,欧洲为50-60%,亚洲为45-50%,美国接近80%,但是预期仍有很大的增长空间。尽管如此,仿制药费用的增长预计将与全球医疗保障费用的增速保持一致,在北美、日本和欧洲成熟市场将呈个位数增长,在中国、巴西和印度等国家,增长率可达10-20%。
全球制药市场正在持续变化,其中最关键的一点就是,未来某个时间,仿制药行业将从这个变化中持续获益。2016年至2019年,将有超过1000亿美元的品牌药专利到期面临仿制药的竞争。
仿制药持续增长的原因是多方面的,既为生产企业创造了机会,也同时带来了风险。比如,政府、公共机构和私有医疗保险公司都将很大程度继续依赖仿制药以控制患者的医疗保险费用,这也为行业的长期发展创造了机会。但同时,这些机构最常做的是减少预算和资源,加上招标时采取的“价低者胜出”的做法给生产商带来很大压力,要求生产商不断降低价格的同时,还要保证质量、安全性、有效性或供应的可靠性;其最终的结果往往是产品供应和利润持续下滑。
与此同时,生产商还不得不与其他各种复杂的挑战做斗争。由于监管日趋严格,则提高了供应链追踪和溯源的要求,以及新的、不断增加的仿制药费用支付,这些都使各国市场为确保合规而增加成本。美国FDA仿制药审批过程中有4000多件ANDA积压,预计批准时间为40个月。预计至少在未来五年,全球领先的创新型公司研发费用将保持每年约750亿美元不变,这意味着未来8-10年内,将不会有大量新药获批上市,仿制药的机会将减少。另一方面,越来越多的CMC开发外包和或大或小的创新型公司原料药和制剂生产外包,也为定制合成与CRAMs(定制研发和生产服务)公司创造了新的机会。最后,在很多国家中,生物药占已上市药物超过40%,同时占临床开发阶段在研药物的37%。随着监管通路的日趋成熟以及各利益相关方对生物类似药的接受,不论生产商是否希望参与竞争,他们都必须对生物类似药有一个清晰的战略。
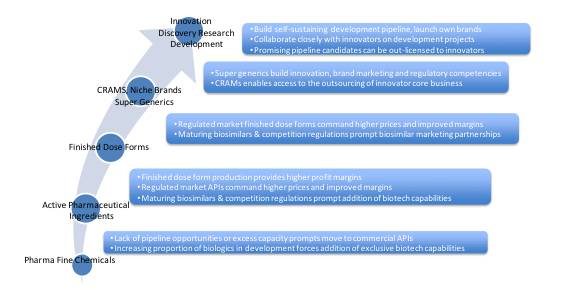
在解决以上问题和挑战之前,公司的商务战略团队围绕行业可行性模式的思考是有价值的。这些思考既可以作为评估一家公司当前定位和能力的衡量标准,也可以作为明确接下来去哪,需要哪些商业能力来达成预期并进行决策的工具,同时还需了解支持这些变化所需的信息。图1所示的行业增长模式可以用来帮助评估与决策。
印度Jubilant Life Sciences是一个很好的案例,展现了如何将自身有机增长与兼并购结合起来,从上世纪70年代的一家小型吡啶化工厂成长为现在年收入数十亿美元的全球化生命科学公司。这个转变需要将复杂的中间体和原料药,与专科药物和生物类似药整合在一起。在这个过程中,该公司花费了7.5亿美元用于在本国及欧洲、美国和加拿大开展收购交易。
让我们来看一下,为了加强地位或者进入任何其他领域以实现增长,CMO公司或者专业合成公司所需考虑的关键战略决策:
同样,仿制药经销商或者生产商所需要考虑的增长策略:
本土、区域性或全球市场拓展
生产更加复杂的剂型,扩大产能和产品管线
从非药政市场转向药政市场
向内向外授权许可,以驱动市场拓展
收购并推广竞争小、有品牌的、利基药或者专科药
生产、销售或者合作销售生物类似药
在美国发起“Paragraph IV”专利挑战
与创新型公司合作,上市授权仿制药
取代或收购竞争对手,获取新的能力和市场
通过整合或收购获取原料药生产
虽然这不是一个详尽的列表,但显而易见,这些战略选择中的任何一项都需要及时、准确和可靠的综合信息和工具,以验证不同的方法并做出正确的决策。比如,为了拓展新的海外市场,不论是CMO还是仿制药生产商,他们都需要透彻了解相关国家和全球药政法规,以便于能够比较和对照不同国家的法规及区别,持续监测这些法规的变化,当进入新市场时,能够评估相关法规的任何变化对业务产生的影响。
往往我们会发现,那些能够成功应对上述商业挑战的公司都有着清晰的增长战略,采用先进的商业情报和信息系统:
包括高度整合的数据,涵盖在研产品线、产品、市场、公司、法规和专利信息等关键内容。
包括开发专业的分析功能,可节省时间和精力,比如:预估仿制药上市日期,而不再重复考虑复杂的专利和市场独占期。
提供与当前和未来业务匹配的区域覆盖范围。
针对检索结果可进行灵活的排序、分析,并具有可视化工具,以便能够快速测试战略并对复杂的商业问题提供解答。
这里举一个例子,这无疑是今天很多公司会面临的情况:新兴市场中的一家仿制药生产商,该公司只有在本土市场上市固体口服制剂的经验,现在通过大规模投资实现了工厂升级,希望能进入利润丰厚的欧美无菌注射剂市场。
强大的、不断增长的产品组合与在研产品管线是所有生产商成功发展战略的重要组成部分。至少,公司的信息解决方案必须能够快速检索和评估现在的、历史的和未来销售预测,上市信息和价格数据,专利信息和市场独占期信息,预测仿制药的上市时间,原料药的供应情况,DMF状态,诉讼,已生效的交易以及更多其他相关因素。专业信息和工具应该能够回答具有代表性的产品组合开发和产品选择等问题,在几秒中里生成一张表格,包含可用于进一步详细评估的候选产品清单:
“哪些产品在美国和欧洲的销售金额在2亿至4亿美元之间?年增长率小于5%,上市剂型为小瓶、安瓿瓶或者注射剂,适应症为心血管、中枢神经系统和肿瘤,同时API供应有限,预计2022年至2028年在德国、意大利或者美国有可能仿制药上市?”
最后一个例子,一旦产品组合确定,那么需要就药政法规信息和解决方案提一些问题,以衡量其对预算和计划的影响:
在所有欧洲国家和美国的市场授权(MA)费用、MA 续期费用、更新时间表、MA 延期费用和年检费用是多少?
在所有欧洲国家的市场授权(MA) 申请预计审查时间为多少?与美国相比如何?有了这些信息,公司可以更有信心地开发产品,按时间表提交申请,确定每个市场的预算,并且最早地了解如果成功获批,产品的预期收入是多少。未来几年,仿制药行业的前景是光明的,但也会面临激烈竞争、更严格的监管环境以及其他压力。但是通过上述多种措施,公司将能够继续把重点放在战略选择、验证和规划上。能够利用综合情报和信息的公司将会获得成功,并继续实现可持续的增长。

**6月15日在线网络研讨会 :
**CPhI现场报告预告:
时间:6月21日下午 2:15 – 2:40
地点:E1馆M15会议室
时间:6月21日下午 2:30-3:30
地点:E2M17会议馆室
**CPhI科睿唯安展位号:E1N21——我们期待您的莅临!
科睿唯安(原汤森路透知识产权与科技集团事业部)对本文的全部内容以及可能附带的全部资料拥有全部知识产权,并受法律保护。网络转载、编译及其他商业使用请联系市场部:[email protected]
点击【阅读原文】注册申请英文报告。
















