论文的研究目标与问题的重要性
这篇论文的研究目标是利用基于结构的药物发现方法,针对钙敏感受体(Calcium-sensing receptor, CaSR)这一重要的G蛋白偶联受体(GPCR),发现新型的正变构调节剂(Positive allosteric modulators, PAMs),以期更有效地抑制**甲状旁腺激素(Parathyroid hormone, PTH)分泌,同时降低现有药物带来的低钙血症(Hypocalcemia)**等副作用。
CaSR在钙稳态调节中发挥关键作用,其功能失调与多种疾病相关,如甲状旁腺功能亢进(Hyperparathyroidism)。目前已有两种PAM药物上市治疗继发性甲状旁腺功能亢进,但常伴有低钙血症等副作用,限制了其使用。

因此,开发新型CaSR PAMs对于更好地治疗相关疾病具有重要意义。
CaSR is present in almost every organ system but is most highly expressed in the parathyroid glands and in the kidneys, where it maintains calcium homeostasis by sensing changes in extracellular calcium levels to regulate PTH secretion, renal calcium reabsorption, and excretion (2, 3). Loss or gain of function in CaSR results in familial hypocalciuric hypercalcemia, primary hyperparathyroidism, and autosomal dominant hypocalcemia (4–8).
Unfortunately, these hyperparathyroidism-treating drugs can induce hypocalcemia and arrhythmias. Hypocalcemia is life-threatening because it can cause seizures and heart failure (11–16).

新思路、方法及其特点
本文采用**分子对接(Molecular docking)这一基于结构的药物发现(Structure-based drug discovery)方法,利用CaSR的高分辨冷冻电镜(Cryo-electron microscopy, cryo-EM)**结构,在一个包含11亿个化合物的超大化合物库中进行虚拟筛选,鉴定出了一系列新的CaSR PAMs。与常规的百万级分子库相比,十亿级分子库筛选的hit rate提高了2.7倍,发现的PAMs也具有更高的活性(最高提高了37倍)和化学多样性。
同时,本研究针对筛选得到的先导化合物进行了结构优化,并获得了多个CaSR-PAM复合物的冷冻电镜结构。结构分析显示,新PAMs在CaSR二聚体两个口袋中诱导了不同的构象变化,使得二聚体构象更接近G蛋白偶联的活性状态。这可能是新PAMs具有更高效力和更少副作用的结构基础。
Seeking new modulators, we docked libraries of 2.7 million and 1.2 billion molecules against the CaSR structure. The billion-molecule docking found new PAMs with a 2.7-fold higher hit rate than the million-molecule library, with hits up to 37-fold more potent.
The cryo-EM structures show that the new PAMs promote CaSR dimer conformations that more closely resemble the activated state than those induced by the established drugs, perhaps contributing to their high potency and new pharmacology.

利用十亿级分子库对接发现新型钙敏感受体PAMs
本研究利用CaSR的冷冻电镜结构,在一个包含11亿个化合物的超大化合物库中进行虚拟筛选,鉴定出了一系列新的CaSR PAMs。与常规的百万级分子库相比,十亿级分子库筛选的hit rate提高了2.7倍,发现的PAMs也具有更高的活性(最高提高了37倍)和化学多样性。这一发现突破了传统小分子库的局限,展示了超大规模分子对接在药物发现中的巨大潜力。
The billion-molecule docking found new PAMs with a 2.7-fold higher hit rate than the million-molecule library, with hits up to 37-fold more potent. Structure-based optimization led to nanomolar leads.

Figure 1. 通过对CaSR的7TM
B
口袋进行十亿级(1.2 billion)和百万级(2.7 million)分子库对接筛选,前者获得了更高的hit rate(36.5% vs 13.6%)以及活性更高的PAMs(EC
50
值最高提高37倍)。右侧展示了几个代表性PAM分子的化学结构。
发现纳摩尔级高效CaSR PAMs
通过对初始筛选hits的结构优化,研究获得了一系列纳摩尔级(nM)高效PAMs。其中'2021和'54149的半数有效浓度(EC
50
)分别达到3.3 nM和41 nM,是目前已知活性最高的CaSR PAMs,比临床药物西那卡塞(Cinacalcet)的活性高出50多倍。
Structure-based optimization improved affinity between 40- and600-fold, leading to molecules that were up to50-fold more potent than cinacalcet in vitro and 10- to 100-fold more potent at suppressing PTH secretion from organs ex vivo and in vivo.

Figure 2. 通过对初始筛选hits(如'5250,'5670,'0522和'21374)进行结构优化,获得了一系列高活性类似物(如'2021,'2460,'5526和'54149),其EC
50
值达到纳摩尔级(nM)。与西那卡塞和依伏卡塞(Evocalcet)相比,这些PAMs也展现出了不同的结构特点。
揭示了新PAMs诱导CaSR二聚体构象变化的新模式
通过对多个CaSR-PAM复合物的冷冻电镜结构分析,研究发现新PAMs在CaSR二聚体两个7TM结构域(7TM
A
和7TM
B
)中诱导了不同的构象变化:7TM
A
结构域PAM采取伸展构象(extended),而7TM
B
结构域PAM则采取弯曲构象(bent)。这使得CaSR二聚体的构象更接近被Gi蛋白稳定的完全活化状态,尤其是'54149诱导的构象变化最为显著。这可能是新PAMs具有更高效力和独特药理学特性(如降低低钙血症风险)的结构基础。
In the active-state receptor, two
CaSR PAMs, cinacalcet and the related evocalcet,
adopt an "extended" conformation within the
seven-transmembrane domain (7 TM) of one
CaSR monomer and a "bent" conformation in
the second monomer of the dimer. These different conformations reflect asymmetric changes in the two allosteric PAM sites upon receptor activation.
 Figure 3. '6218和'54149分别与CaSR 7TM
A
和7TM
B
结合的冷冻电镜结构。两个PAM分子在7TM
A
中呈现伸展构象,在7TM
B
中呈现弯曲构象。同时诱导受体发生一定程度的构象变化,这与分子对接模拟的结果基本一致。
Figure 3. '6218和'54149分别与CaSR 7TM
A
和7TM
B
结合的冷冻电镜结构。两个PAM分子在7TM
A
中呈现伸展构象,在7TM
B
中呈现弯曲构象。同时诱导受体发生一定程度的构象变化,这与分子对接模拟的结果基本一致。

Figure 4. 与西那卡塞结合的CaSR相比,'54149和'6218结合后诱导CaSR 7TM
A
结构域向胞内方向运动,使得二聚体界面有更多的相互作用,更接近被G蛋白稳定的活性构象。这可能是'54149和'6218具有更高效力的结构基础。同时,'54149和'6218在抑制小鼠甲状旁腺PTH分泌方面也表现出了比西那卡塞和依伏卡塞更高的效力。
'54149在动物体内表现出更好的PTH抑制效果和更低的低钙血症风险
研究选择先导化合物'54149进行了系统的药效学评价。小鼠给药实验显示,'54149在3 mg/kg剂量下可以持续抑制血清PTH水平达8小时之久,效果明显优于西那卡塞。更重要的是,该剂量'54149并未引起明显的血钙下降,而相同剂量的西那卡塞和依伏卡塞都会导致显著的低钙血症。提示'54149具有更高的体内药效学和更好的安全性。
At 3 mg/kg, '54149 did not substantially alter serum calcium concentration for 4 hours but slightly increased it from 2.2 to 2.4 mM after the drug dissipated in circulation 6 hours after injection (Fig. 5E). By contrast, the same dose of cinacalcet and evocalcet substantially lowered serum calcium for more than 8 hours, from 2.2 mM to 1.7 and 1.6 mM at trough, respectively.

Figure 5. '54149在小鼠体内的药代动力学、药效学和安全性评价。3 mg/kg剂量下,'54149可以持续抑制血清PTH达8小时之久,效果优于西那卡塞,且未引起明显的血钙下降。而相同剂量的西那卡塞和依伏卡塞都会导致显著的低钙血症。
小结
本研究利用CaSR冷冻电镜结构指导的超大规模分子库对接,发现了一系列新型高效CaSR PAMs,其中'54149和'2021展现出纳摩尔级别的体外活性,分别比已上市药物西那卡塞高出50多倍和21倍。结构生物学研究揭示,这些新PAMs诱导CaSR形成不同于已知药物的二聚体构象,更接近被G蛋白稳定的完全活化状态。动物实验进一步证实,'54149在体内具有更好的PTH抑制效果和更低的低钙血症风险。这些发现为开发新一代CaSR调节剂药物提供了重要线索,展示了超大规模分子库对接在GPCR等重要药物靶点领域的应用潜力。

研究成果的影响、应用场景和商业机会
本研究发现的新型CaSR PAMs具有更高的效力和更少的副作用,有望用于更安全有效地治疗继发性甲状旁腺功能亢进和甲状旁腺癌等疾病。这不仅为患者带来了更多的治疗选择,也为制药企业提供了开发全新一类CaSR靶向药物的机会。作为药物研发人员,应重点关注新PAMs的体内药效、安全性评价、作用机制以及临床开发等方面。
同时,这项研究展示了利用冷冻电镜结构结合超大规模分子对接进行药物发现的巨大潜力。这一策略有望推动GPCR等具有重要生理病理功能和药物价值的靶点的药物发现。相关的计算模型优化、化合物库拓展、筛选流程自动化等技术也有望成为制药领域的投资热点。
Our findings highlight the importance of library size in molecular docking and provide a foundation for discovering therapeutic modulators for other challenging targets.
Our study demonstrates that expanding docking libraries improves the discovery of new CaSR PAMs. By leveraging high-resolution cryo-EM structures and large library docking, we identified previously unknown chemotypes that can modulate PTH secretion, apparently without inducing hypocalcemia. This approach offers a promising strategy for developing safer and more effective drugs for conditions such as secondary hyperparathyroidism and parathyroid cancer.

进一步探索的问题、挑战及新机会
尽管本研究取得了重要进展,但还有一些问题值得进一步探索:
新PAMs在体内的药代动力学性质、代谢稳定性、安全性等仍需深入评估和优化。
不同PAMs诱导的CaSR构象变化与其独特药理作用(如对低钙血症的影响)之间的关联有待进一步阐明。这可能需要更多的结构生物学和细胞/动物实验的结合。
CaSR除了调控PTH外,在许多其他组织中也发挥着重要作用。新PAMs对这些生理功能的影响以及在相关疾病中的治疗潜力有待系统研究。
同时,随着GPCR等重要药物靶点的高分辨结构日益丰富,结构指导的药物发现有望在更大范围内得到应用。这需要开发更加高效、精准的分子对接等计算工具,建立更加庞大、多样的可筛选化合物库,以及优化针对特定靶点的筛选流程等。相关技术的进步不仅会加速新药研发,也将催生出新的投资机会。
Although the pharmacokinetics of '54149 are sufficient to support in vivo studies, and indeed in some ways to demonstrate superiority to cinacalcet, optimization of exposure and half-life of the molecule will be necessary. Although the relative lack of a hypocalcemic effect is encouraging, understanding the mechanism underlying this effect requires systematic exploration of CaSR activation in other calciotropic organs, including bones and kidneys.

Critical Thinking
研究主要在小鼠模型中开展,新PAMs在人体内的药效和安全性仍需临床试验的验证。物种差异可能影响药物作用。
虽然体外细胞和组织实验提示新PAMs具有更高的效力和更少的低钙血症副作用,但其具体机制尚不清楚。更多的分子和细胞机制研究有助于解释这些差异。
研究使用了11亿化合物的超大化合物库进行筛选,这在计算和实验资源上都是一个巨大的挑战。筛选和测试的化合物数量仍然有限,结果的统计显著性有待提高。
We do not suggest that the molecules described here are drugs. Whereas the pharmacokinetics of '54149 are sufficient to support in vivo studies, and indeed in some ways to demonstrate superiority to cinacalcet, optimization of exposure and half-life of the molecule will be necessary.
Although the improvement in docking hit rates and docking potencies from billion-molecule versus million-molecule libraries seems compelling, the numbers experimentally tested remain relatively low given docking uncertainties.
总之,这项研究利用冷冻电镜结构指导的超大规模分子库对接,发现了一系列新型CaSR PAMs,为治疗继发性甲状旁腺功能亢进提供了新的候选药物。同时,这一研究策略也为其他GPCR等具有重要药物价值的靶点的药物发现提供了新思路。


Biosyn导师:Brian K. Shoichethttps://pharmacy.ucsf.edu/brian-shoichet
Brian K. Shoichet是加州大学旧金山分校(UCSF)药学院的教授,担任药学院研究生教育项目的联合副院长。他主要从事计算药物化学和化学生物学方面的研究。
他的研究兴趣包括:
开发新的计算方法用于配体发现和药物设计,特别是针对G蛋白偶联受体(GPCR)这一重要的药物作用靶点。
利用实验方法如X射线晶体学和热力学测量来验证计算方法的可靠性,并研究药物分子的物理化学性质如何影响其体外和体内行为,从而指导药物递送和制剂。
开发新的计算方法来比较分析受体之间的相似性,这种方法基于受体配体的相似性而非传统的蛋白质序列或结构相似性。这可以发现一些出人意料的药理学关系,有助于发现药物和探针分子作用于整个生物体的化学调控网络。
Shoichet教授拥有麻省理工学院化学和历史双学士学位,以及加州大学旧金山分校的分子对接博士学位。他的实验室致力于发现能够阐明重要生物学问题的化学试剂和药物先导化合物,采用了计算与实验紧密结合的策略。
一方面,他们利用蛋白质结构来预测新的配体和药物先导化合物(基于结构的配体发现)。另一方面,他们也研究生物大分子在健康和疾病状态下是如何相互作用的。这两个过程都涉及大量的分子模拟和计算与实验的密切合作。
Shoichet教授在计算药物设计、化学生物学、G蛋白偶联受体、β-内酰胺酶、药物的物理化学性质等领域做出了重要贡献,发表了大量高水平论文,是国际公认的领军人物。他领导的研究对推动药物发现新方法和揭示药物作用新机制具有重要意义。
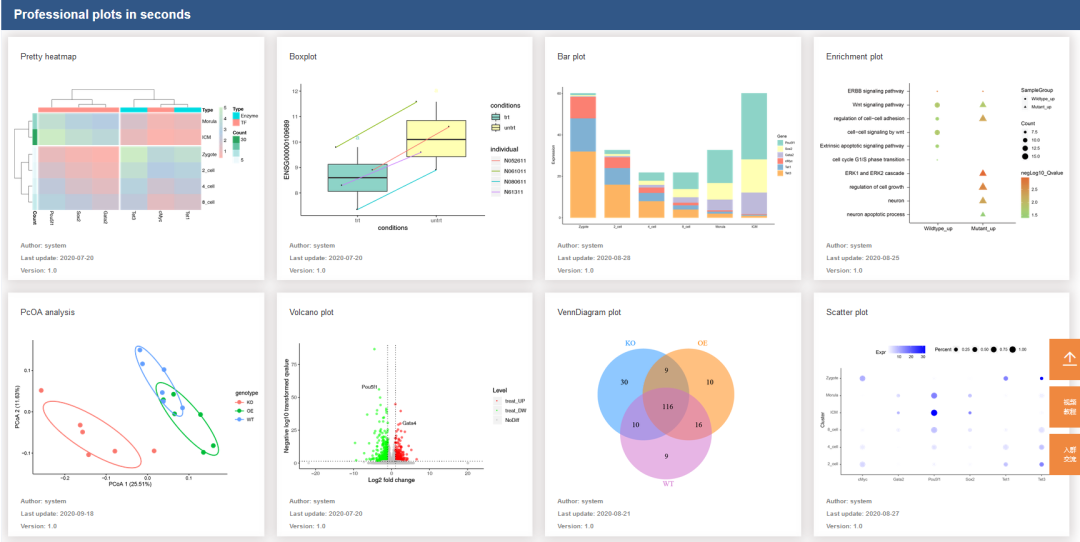
高颜值免费 SCI 在线绘图(点击图片直达)
最全植物基因组数据库IMP (点击图片直达)
往期精品(点击图片直达文字对应教程)
机器学习