
内皮糖萼位于内皮细胞(ECs)膜表面,与血液直接接触,被认为是一个重要的保护层。它是由蛋白聚糖和糖蛋白组成的网络复合物,附着在EC膜上,其核心蛋白和糖胺聚糖[如硫酸肝素、硫酸软骨素、透明质酸(HA)等]侧链连接在蛋白聚糖上。糖萼呈现出纳米和微米尺度的“灌木状”结构,也称为聚集形态。它具有血管守门员的功能,通过影响血管的机械传导、渗透性、血栓形成和白细胞粘附,在内皮细胞与血液以及相邻细胞之间形成屏障,并为白细胞运动提供润滑层。此外,它还在介导炎症反应中发挥关键作用,从而抑制初级白细胞捕获和系统性白细胞外渗,并提供物理屏障以调节和定位白细胞招募到发炎的血管化组织。内皮糖萼是血管的天然保护层。在血管植入物上高效构建可靠的糖萼模拟涂层具有巨大的潜力,但仍然是一个挑战。
来自四川大学的王云兵等团队
开发了一种具有簇状形态和亲水润滑特性的新型糖萼模拟涂层,通过聚乙烯亚胺(PEI)和磷酸胆碱改性的透明质酸(HA-PC)层层自组装实现。HA-PC中的两性离子PC基团表现出抗聚电解质效应,诱导HA在溶液中的分子折叠和聚集,并增强其与PEI的结合能力,从而形成类似内皮糖萼的簇状形态。此外,两性离子而不是疏水基团,可以通过与HA的空间协同作用实现亲水润滑特性,同时诱导HA的分子折叠,最终构建出一种糖萼模拟涂层。这样的涂层可以很好地作为血管支架的保护层,凭借其在体内外出色的抗凝、抗炎和促进内皮细胞生长的特性。这些发现不仅为PC改性的聚电解质之间的相互作用提供了新的见解,还为血管植入物提供了一个有前景的糖萼模拟涂层。相关工作以题为
“Armoring Vascular Implant by Glycocalyx-Mimetic Coating with Clustered Morphology and Hydrophilic Lubrication”
的文章发表在2025年01月09日的期刊
《Advanced Functional Materials》。

1.创新型研究内容
首先,MEA中的巯基与MPC单体中的双键反应生成带有氨基的PC(PC-NH
2
)(图1A)。这是一个经典的点击反应,在DMAP催化剂的存在下可以高效完成,控制MPC过量50%。通过核磁共振(NMR)分析PC-NH
2
发现,MPC中双键连接的甲基峰从1.86移动到1.17 ppm。通过计算两个峰面积的比值,发现94.9%的MEA发生了反应。接下来进行经典的EDC缩合试验:HA中的羧基与PC-NH
2
反应,通过透析和冻干得到目标产物HA-PC。正如NMR分析所揭示的,3.18 ppm处的峰被定义为连接到PC组季铵盐上的甲基峰,这表明PC组已经成功嫁接到HA分子链上。通过NMR和XPS数据的计算结果,PC组的嫁接比为41.57–43.00%。为了证明HA-PC中存在的抗电解质性质,本文测试了10 mg mL
-1
聚合物在纯水和盐溶液中的粘度。如图1B所示,HA-PC在纯水中的粘度在10 s
-1
剪切速率下为20 mPa·s,并在盐溶液中下降到7 mPa·s,表现出典型的抗电解质性质。这可能是因为具有抗电解质性质的PC在纯水中自聚集导致HA分子链收缩,从而增加了分子间力和粘度。在有盐存在时,PC组中的正/负电荷相互作用被破坏,这削弱了分子间力并伸展了分子链,从而降低了粘度。相比之下,HA表现出典型的电解质性质,在盐溶液中的粘度为75 mPa·s,而在水溶液中仅为0.8 mPa·s,这是因为盐抑制了HA的解离,从而提高了其粘度。带负电的HA可以通过静电吸附与带正电的PEI聚集,而带正电的聚合物也可以与两性离子聚合物聚集。因此,带有两性离子功能团的HA-PC与PEI之间的相互作用值得深入研究。
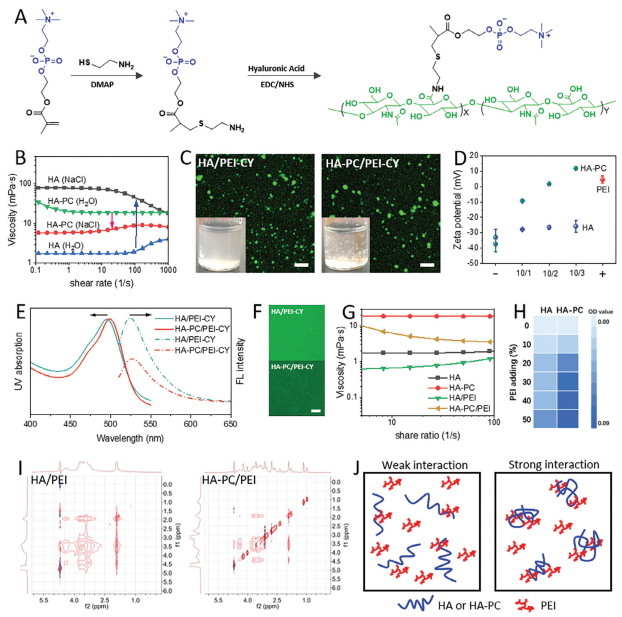
图1 HA-PC的合成及其与PEI的相互作用
本文采用了传统的LBL自组装方法来制备具有糖萼仿生结构的涂层。首先,通过QCM-d(图2A)对涂层制备过程进行了研究,发现HA-PC吸附引起的频率变化(ΔF)为1250 Hz,当涂层制备到第二层时显著高于HA引起的频率变化(200 Hz)。这表明HA-PC具有强大的吸附效率,进一步证实了我们的假设,即引入PC极大地提高了HA与PEI的结合能力,这对耗时的LBL自组装方法具有重要意义。在具体分析中,由于交联和相互作用的差异,吸附物质形成的组装层在密度、硬度和其他特性上有所不同。在我们的分析中,通常使用ΔD/ΔF表示组装层的刚度变化。通过计算图2A中记录的最终组装平衡状态下F和D的绝对差值,可以观察到HA-PC/PEI组装层比未改性的HA/PEI更柔软。由于HA-PC与PEI之间强大的结合力,制备相同层数时,HA-PC/PEI涂层的厚度达到982 nm,而HA/PEI涂层仅为430 nm。同样,HA-PC与PEI之间的强大结合力使HA-PC/PEI涂层更加稳定。在PBS中浸泡10天后,HA-PC/PEI涂层的荧光强度降至初始值的58%,而HA/PEI涂层降至初始值的19%(图2I)。LBL自组装基于两种聚合物间的静电吸附,因此研究了涂层过程中表面Zeta电位的变化(图2B)。材料/涂层表面的Zeta电位呈现规律性的正负切换,表明LBL自组装成功。随后进行XPS以分析涂层处理后表面的元素分布(图2C)。与PLA相比,涂覆PEI和HA的材料表面显示出强烈的氮(N)元素信号,因为PEI和HA都含有N元素。在局部放大后,从HA-PC涂层中观察到明显的磷(P)元素信号峰在133 eV处(图2D)。以上结果表明涂层的成功制备。
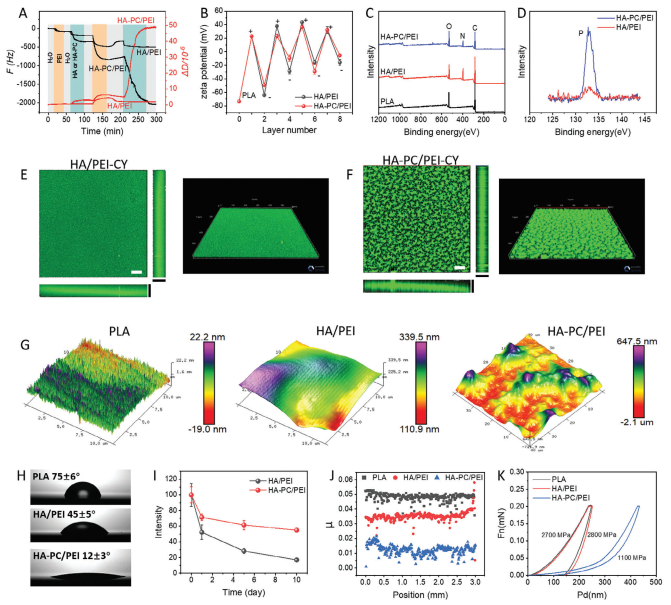
图2 通过LBL自组装制备涂层及涂层的性质
血液相容性是心血管假体表面改性的首要考虑因素。首先,检测了材料/涂层的溶血率,结果(图3A)表明所有样品的溶血率均低于1%,这表明涂层处理没有破坏红细胞。此外,研究了材料表面的血小板粘附情况,因为这是血栓形成的初始事件,而具有抗血小板粘附功能的涂层被认为具有更好的抗血栓功能。如图3B-D所示,大量的血小板(约68 × 10
5
mm
-2
)粘附在PLA材料表面,而在HA/PEI处理后显著减少到约20 × 10
5
mm
-2
,这与涂层的亲水性密切相关。然而,经过HA-PC/PEI处理的涂层进一步减少了血小板粘附(仅5 × 10
5
mm
-2
),视野内几乎看不到粘附的血小板。这表明引入PC进一步提高了涂层的亲水性,从而减弱了血小板的粘附,类似于内皮糖萼。特别是,引入PC可以增强涂层的吸水能力,实现局部防污增强效果,从而具有优越的防污和抗凝可靠性。这一点通过HA-PC/PEI涂层对血浆蛋白吸附表现出良好的抵抗力得到了证实。
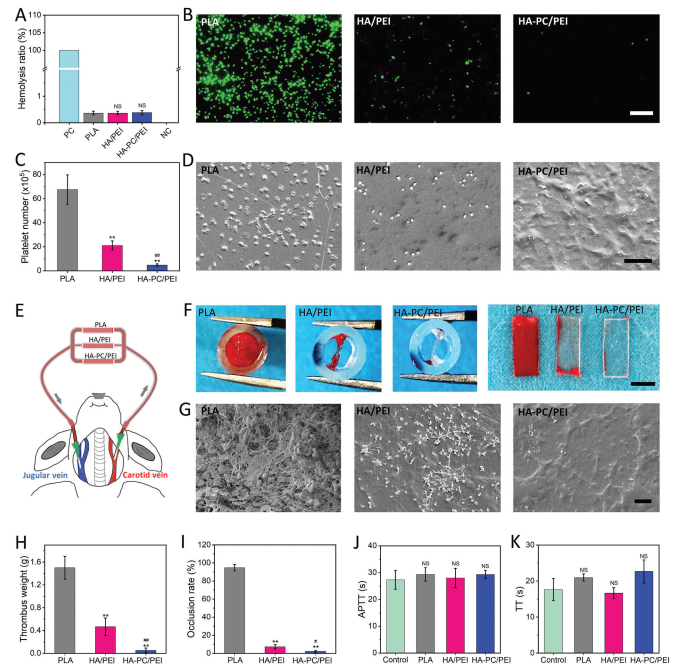
图3 涂层的血液相容性研究
对提取物进行了细胞毒性实验,以探究材料/表面的细胞相容性(图4A、B)。所有样本的细胞存活率与空白对照组相比均超过了80%,这表明涂层对L929成纤维细胞无毒性。心血管材料植入后可能引发体内反应,导致内皮损伤,引起急性和慢性炎症,并促进血栓形成。特别是,巨噬细胞在整个炎症反应中是核心细胞。因此,研究这些涂层对巨噬细胞的影响至关重要。因此,对涂层对巨噬细胞的影响进行了研究。首先调查了RAW264.7巨噬细胞在材料表面的粘附情况。如图4C、D所示,发现大量巨噬细胞粘附在PLA表面,多达440个细胞每平方毫米,而在HA/PEI改性后数量减少到150个细胞每平方毫米,进一步经HA-PC/PEI改性后减少到98个细胞每平方毫米。这表明具有亲水润滑和聚集形态的HA-PC/PEI涂层可以减弱巨噬细胞的粘附,有利于减轻材料引起的炎症反应。尤其是,当巨噬细胞被LPS激活时,HA-PC/PEI涂层仍然能减少巨噬细胞的粘附。
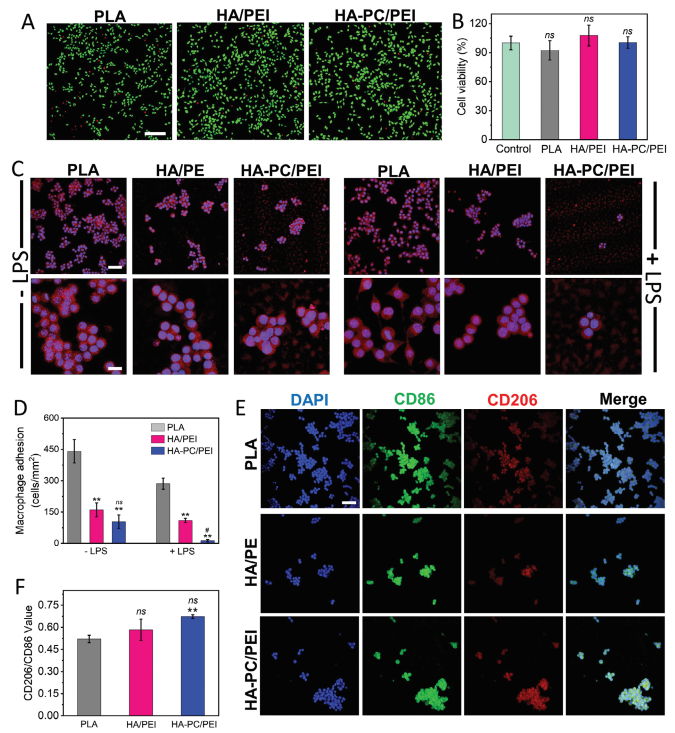
图4 材料/涂层的细胞相容性
选择了冠状动脉支架植入作为动物实验模型,通过LBL自组装方法在可吸收的PLA支架上制备涂层,然后在荧光显微镜下观察。如图5A所示,涂层均匀且完全覆盖了支架表面。当确认HA-PC/PEI涂层成功覆盖复杂形状的物体并保持其完整性时,它们可以用于后续的动物体内植入实验。将带有各种涂层的支架植入新西兰白兔的腹主动脉中。1个月和3个月后取出支架进行组织学观察和分析。根据H&E染色(图5B),PLA组(未经任何修饰的裸支架)的新内膜厚度显著大于HA/PEI涂层支架和HA-PC/PEI涂层支架,而HA-PC/PEI涂层支架的新内膜厚度最小。即使在3个月后,也没有检测到内膜增生,支架被新内膜完全覆盖,这对于维持血管通畅至关重要。支架植入后的炎症特别有害,因为它引起或加剧再狭窄和内皮过度增生。进一步通过CD68(绿色)免疫荧光染色分析了新生组织中的炎症反应。从CD68表达可以看出(图5C、D),HA-PC/PEI涂层改性组的CD68荧光强度明显降低至14,而PLA裸支架的荧光强度高达27。这表明在HA-PC/PEI涂层改性支架植入期间,炎症反应显著受到抑制,这归因于涂层的抗炎活性,与之前对巨噬细胞的实验结果一致。根据之前的报告,涂层的形态和硬度会影响细胞表型,尤其对于内皮细胞和炎性细胞。PC带来的特殊形态和柔软机械性能可能是动物实验结果良好的主要原因。总的来说,HA-PC/PEI具有理想的组织相容性和宿主整合性。
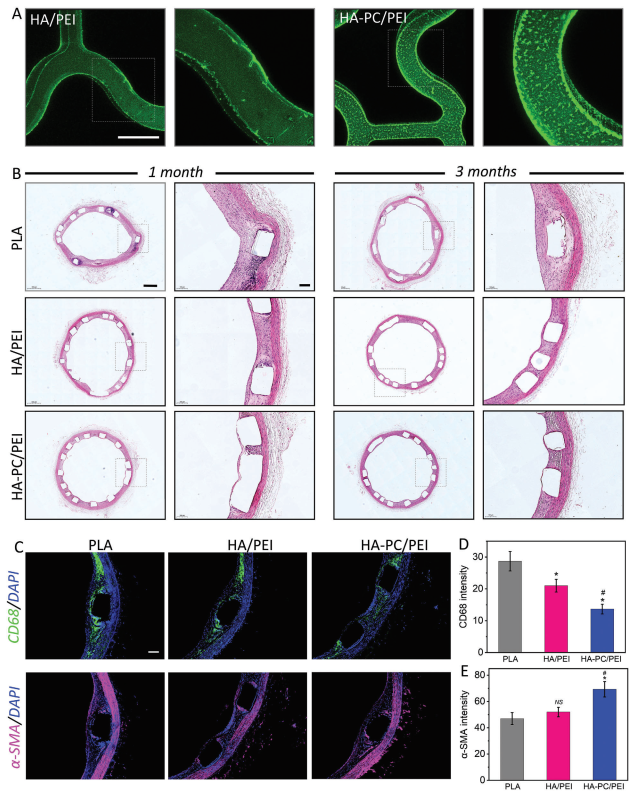
图5 支架植入实验
血管壁的内皮细胞层对于维持血管微环境的稳态具有重要意义。健康的内皮细胞膜具有天然抗凝成分如肝素硫酸盐、前列腺素(PGI2)和一氧化氮(NO),它们能够合成和分泌各种生物活性物质,保证正常的血管收缩和舒张,从而保持血管的正常流动和长期通畅。因此,快速实现植入血管支架的内皮化是血管支架表面改性的关键目标。在本研究中,对植入血管支架新生内膜表面的内皮细胞进行了评估。CD31和eNOS是血管内皮细胞表达的标志蛋白,对维持内皮细胞正常功能和血管微环境稳态发挥重要作用[60]。因此,它们也作为验证内皮细胞存在和正常功能的标记物。实施了CD31、eNOS和细胞核在新生内膜表面的免疫荧光染色(图6B),并对细胞数量以及CD31和eNOS的表达进行了定量分析(图6C-E)。尽管PLA支架、HA/PEI涂层支架和HA-PC/PEI涂层支架表面的细胞数量差异不显著,但HA-PC/PEI涂层支架内膜表面的CD31和eNOS表达水平高于PLA和HA/PEI涂层。这些结果表明,HA-PC/PEI涂层组的血管支架新生内膜在植入后3个月表现出更好的生物学功能,显示出具有类内皮糖萼功能的簇状涂层可以显著改善血管支架新生内膜的内皮功能,展示出更好的体内性能。总之,引入PC利用抗聚电解质效应,而HA-PC分子的自折叠形成了具有独特物理性质的多层膜,表现为类似生物仿生内皮糖萼的簇状形态,提供了更好的润滑保护和更柔软的涂层特性。此外,HA-PC/PEI涂层引入了两个额外的物理性质:独特的形态和更柔软的表面,这两者都在调节细胞命运方面发挥了重要作用。这主要体现在不同心血管细胞对不同物理形态尺度和物理硬度的不同敏感性,内皮细胞糖萼也可以调节炎症细胞的命运等。因此,HA-PC/PEI涂层的一个重要功能可能是调节心血管细胞的命运。





