trans-八氢吲哚酸的合成及其在不对称串联反应中的应用
The Synthesis of trans-Perhydroindolic Acids and Their Application in
Asymmetric Organocatalyzed Cascade Reactions
刘德龙1,张万斌1,2*
(1. 上海交通大学药学院,上海 200240;2. 上海交通大学化学化工学院,上海 200240)
摘要:
(2S,3aR,7aS)-八氢-1H-吲哚-2-甲酸(trans-八氢吲哚酸1a),是合成抗高血压药群多普利的关键中间体。由于其分子
结构中存在3 个手性中心( 其中有2 个为呈反式构型的桥头氢),1a 的高效合成始终是群多普利能否廉价易得的一个挑战。我们在综合文献和大量实验探索的基础上,选择从关键的反式桥头氢构建入手,设计了1a 的全新合成路线并进行了合成工艺优化。从另一方面看,1a 连同其合成过程中同时生成的另外3 个副产物(1b ~ 1d,共4 个trans- 八氢吲哚酸) 具有非常独特的结构特征:在脯氨酸的结构基础上,增加了1 个刚性六元骈环以及2 个反式桥头氢。这使得trans- 八氢吲哚酸被作为脯氨酸类手性小分子催化剂在多个不对称催化反应中均取得了高效的不对称催化效果。本文简要综述了本课题组对1a 及其副产物1b ~ 1d 的合成探索,及其所催化的不对称串联反应合成多手性中心脂肪碳环、氧杂环特别是氮杂环化合物的进展。
关键词:
群多普利;关键中间体;有机小分子催化剂;不对称串联反应;手性

群多普利( trandolapril, 图1), 化学名为
(2S,3aR,7aS)-1-[[(2S)-[(1S)-( 乙氧羰基) 苯基丙基] 氨基] 丙酰基] 八氢-1H- 吲哚-2- 羧酸,最早是由法国Roussel Uclaf 公司、Knoll 公司和德国Hoechst 公司共同开发,并由Roussel Uclaf 公司于1993 年首次在法国上市、2004 年在北美上市的抗高血压药物。该药是一种长效心血管紧张素转化酶抑制剂,可用于治疗多种心血管疾病,且具有疗效显著、起效快、作用时间长、不良反应较少,且一日一次给药即达治疗作用的优点[1]。
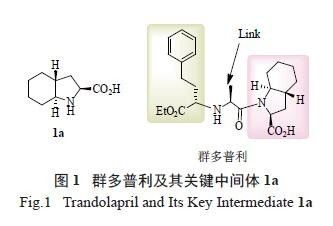
从分子结构来看,群多普利分子由3 部分构成:
左边的侧链、中间的连接基及右侧的脯氨酸类母核trans- 八氢吲哚酸。左边的手性苯丁酸酯侧链是多种普利类药物的共同中间体,其高效合成方法已有报道[2—3] ;中间的连接基为天然氨基酸,可很方便地获得;右侧的脯氨酸类母核(2S,3aR,7aS)- 八氢-1H- 吲哚-2- 甲酸(1a) 则是合成该药的关键中间体。该母核能否实现廉价易得,是群多普利可否被广泛应用于临床的关键因素。
1 trans- 八氢吲哚酸的合成
文献报道的关于群多普利的合成也多侧重于该
脯氨酸类母核1a 的构建,并有较多的合成方法见诸报道。从不同合成原料的角度,可将所报道的合成方法归纳为以下几种:分别是以1,1,3,3- 四甲氧基丙烷[4—6]、环己烯[7—9]、六氢邻苯二甲酸酐[10—11]、消旋的六氢吲哚[12]、环己酮[13—14]、丝氨酸[15],为原料合成1a。这些方法虽然取得了一定的进展,但却存在着不同程度的合成路线较长、操作烦琐或总收率低的缺点。更为关键的是,1a 分子结构中含有3 个手性中心,且骈环的两个桥头氢是呈反式结构,为其合成增加了一定的难度。现有文献方法所得到的产物往往伴随着顺式结构的形成,大大降低了合成效率。所以,要高效合成该脯氨酸类母核1a,如何高效构建反式桥头氢当是首要解决的问题。
按此思路,我们从构建反式桥头氢出发,设计
了1a 的一条高效合成路线( 图2) [16]。以N- 对甲苯磺酰基-7- 氮杂二环[4.1.0] 庚烷(2) 为原料,与格氏试剂反应,以95%的收率得到全反式构型的开环产物3。3 再经间氯过氧苯甲酸(m-CPBA) 氧化后自动关环即得全反式骈环氨基醇4,收率91%。然后利用Jone's 试剂将化合物4 分子中的羟甲基氧化为羧基并脱保护后,得到消旋的trans- 八氢吲哚酸rac-1。4 步反应的总收率约49%。要得到光学纯的1a,首先将rac-1 与苄醇在酸催化下反应得trans- 八氢吲哚酸苄酯6,经重结晶和手性拆分后再脱苄基保护即可得1a( 总收率14.8% )。该策略的优势之一就是氧化关环时得到全反式骈环氨基醇产物4,大大提高了群多普利的合成效率。
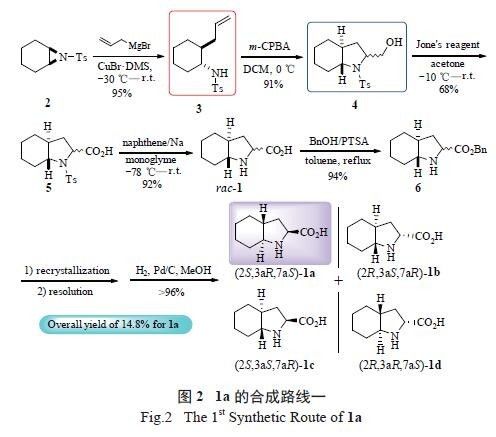
从合成成本及环境影响的角度,上述合成工艺
依然有值得改进的地方:①合成路线中以萘钠脱除化合物5 中氮原子上的保护基,以及产物rac-1 需经过树脂柱加以分离,操作较为繁琐且合成规模难以放大。②合成工艺还有待进一步的优化,以减少有毒、有污染试剂的使用及排放。因此,我们又对原合成策略进行合成路线的调整及合成工艺优化,进一步提高1a 的合成效率( 图3)。
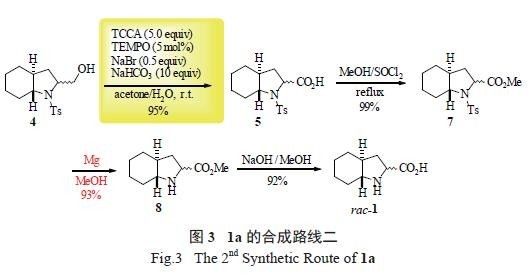
2 trans- 八氢吲哚酸在不对称串联反应中的应用
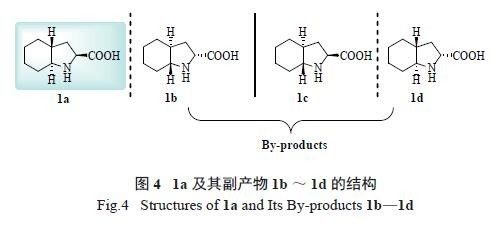
虽然上述合成策略可以方便地合成1a,但同时也得到3 个与之分子结构相同、构型各异的副产物1b ~ 1d。这些副产物如何转化或再利用则是合成群多普利的另一个挑战。从结构来看,这些trans-八氢吲哚酸在基于脯氨酸的基本骨架上,还拥有1个刚性的六元骈环及2 个反式结构的桥头氢( 图4),有望在不对称催化反应中取得优异的催化效果。
2.1 trans- 八氢吲哚酸在不对称Michael 加成反应中
的尝试
基于上述考虑,trans- 八氢吲哚酸(1a ~ 1d)
首先被应用于经典的模板反应——简单醛与硝基烯烃的不对称Michael 加成反应中。对反应条件进行优化时发现,在仅利用2 ~ 5 mol%的1d 为催化剂时,所有反应便可顺利进行,并取得高达99%收率、99 ∶ 1 dr 和98% ee 的高效不对称催化效果( 图5)[18]。
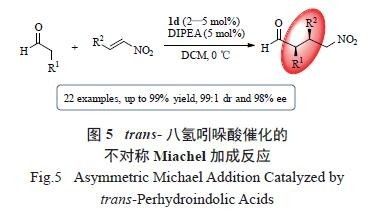
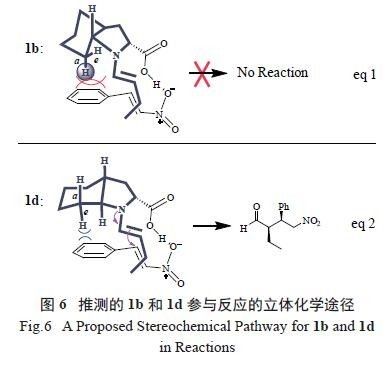
试验结果显示,同样作为一对对映异构体,催
化剂1a 与1b 对该反应几乎没有催化活性。而另一对对映异构体1c 和1d 则取得了优异的不对称催化效果。可以看出,trans- 八氢吲哚酸的结构,尤其是左侧的六元骈环以及2 个反式的桥头氢对反应起到了关键的作用。对照产物的绝对构型,催化剂结构对反应的影响推测如下( 图6)。
2.2 trans- 八氢吲哚酸在不对称串联反应中构建多
手性环戊烷化合物
手性连续多取代环戊烷是一类重要的骨架,广
泛存在于具有生物活性的天然产物和药物中,也可作为有机合成的重要中间体。但目前报道的工作多集中于合成六元环骨架的手性连续多取代环己烷烃化合物,而相应的环戊烷类骨架化合物的研究较少,且催化效果也不是很理想( 反应收率低、活性差或选择性差) [19]。因此,我们设计了醛酯与硝基烯烃的不对称Michael-Michael 串联反应,在trans- 八氢吲哚酸1c 催化下合成了一系列含有连续四手性中心的环戊烷类化合物。产物最高可达到98%的收率、大于99 ∶ 1 dr 以及99% ee 的立体选择性( 图7)[20]。需要指出的是,该反应中1c 和1d 较脯氨酸以及其他一些常见的脯氨酸类小分子催化剂表现出更好的不对称催化效果。
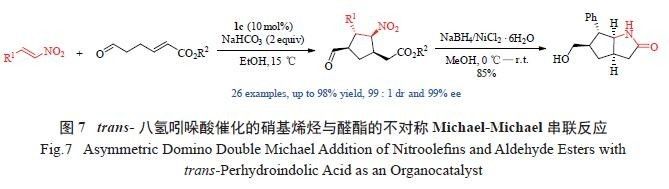
这些催化产物可经一步还原关环即得稠合双环
内酰胺化合物,为这类化合物的合成提供了一种简便有效的合成方法。
2.3 trans- 八氢吲哚酸在不对称串联反应中构建氧
杂环化合物
杂环化合物是重要的有机合成砌块,其中手性
四氢吡喃环(THP) 是天然有机化合物中最常见的杂环结构之一。在成功构建多手性中心脂肪碳环后,我们又将目光聚焦于手性四氢吡喃杂环化合物的合成,设计了1d 催化的醛酯类化合物与γ- 芳基-β,γ-不饱和-α- 酮酯的不对称串联反应。该反应以优异的不对称催化效果得到了具有多取代吡喃结构的手性氧杂环化合物( 图8)[16]。试验结果显示,trans-八氢吲哚酸是一类用于构建氧杂环化合物反应的高效手性小分子催化剂。

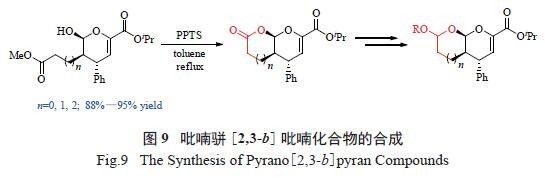
吡喃骈吡喃环(perhydropyrano[2,3-b]pyran) 也
是一类重要的结构,存在于许多具有生物活性的天然产物及药物分子骨架中。我们发现,上述手性四氢吡喃杂环化合物可以方便地转化为多手性中心的吡喃骈吡喃结构化合物。该方法也为合成多取代的手性吡喃骈吡喃类化合物提供了一条简便高效的途径( 图9)[16]。
通过底物设计,我们合成了取代基更为丰富
的手性多取代吡喃化合物。将1d 作为手性脯氨酸类催化剂催化醛氨与β,γ- 不饱和-α- 酮酯的不对称Michael 加成/ 环化串联反应,在优化的反应条件下,具有不同取代基的底物都可取得非常好的不对称催化效果( 最高93% ee 及大于99 ∶ 1 dr)。该反应进一步显示了trans- 八氢吲哚酸是一类非常优秀的脯氨酸类手性小分子催化剂( 图10)[21]。
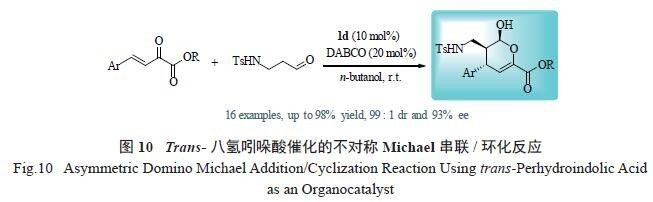
2.4 trans- 八氢吲哚酸在不对称串联反应中构建氮杂环化合
物
事实上,含氮杂环化合物广泛存在于生物活性
的天然产物和药物中。据FDA 统计,目前上市的小分子药物中,有59%的药物含有氮杂环结构[22]。在成功合成了几例手性氧杂环化合物后,我们将研究重心转移至手性氮杂环化合物的构建。首先,对trans- 八氢吲哚酸催化的环状N- 磺酰亚胺和简单醛的不对称aza-Diels-Alder 反应性能进行了研究[23]。在优化的反应条件下,反应均可取得高效的不对称催化效果( 最高89%收率和99% ee 的对映选择性)。然而,该反应却只能获得最高80 ∶ 20 dr 的非对映选择性( 图11)。
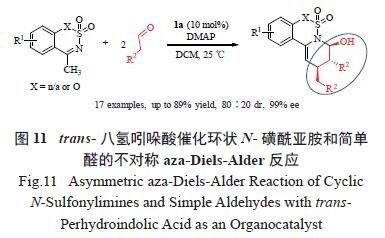
催化产物中除了3 个连续的手性中心外,还包
含氨缩醛羟基以及烯胺双键等易于转化的官能团,为催化产物进一步衍生提供了可能。例如,在2-碘酰基苯甲酸(IBX) 作氧化剂时,氨缩醛羟基被氧化为羰基而得到手性δ- 内酰胺类化合物。该六元环手性酰胺常见于天然产物或药物的骨架之中,但合成方法较少。进一步以Pd/C 为催化剂,通过催化加氢还原烯胺双键得到全氢手性δ- 内酰胺。然后,通过萘钠试剂脱除磺酰基,得到N- 不保护的全氢手性δ- 内酰胺( 图12)。
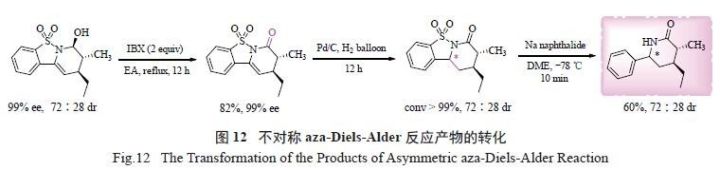
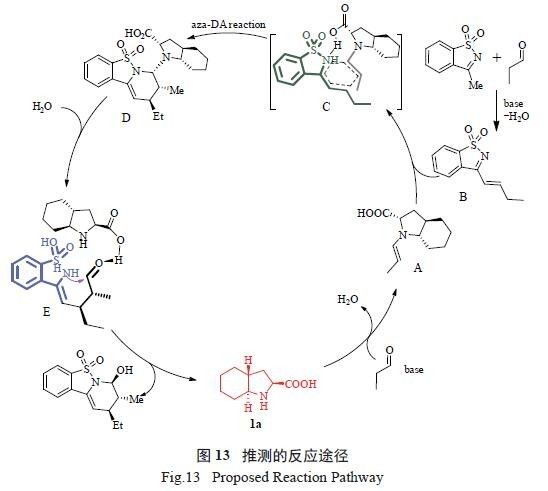
试验研究揭示了该反应是经过了α,β- 不饱和
亚胺与简单醛之间的不对称aza-Diels-Alder 反应步骤。推测反应历程如下:首先,催化剂1a 与一分子丙醛反应得到亲核的烯胺中间体A,同时环状磺酰酮亚胺在碱性条件下与另一分子丙醛缩合原位生成α,β- 不饱和亚胺中间体B。然后,烯胺中间体A与亚胺中间体B 之间发生不对称aza-Diels-Alder 反应,经过渡态C 形成中间产物D。D 在水分子作用
下再发生水解反应形成中间体E。最后,在催化剂
诱导下,E 又进一步环化得到目标产物,同时释放出催化剂1a( 图13)。
基于上述反应机理,我们以trans- 八氢吲哚酸
催化事先制备的环状共轭N- 磺酰亚胺与丙醛的不对称aza-Diels-Alder 反应,可以合成具有广泛生理活性的4- 芳基取代手性哌啶杂环化合物,进一步拓展该反应的应用范围。经过反应条件优化,几乎所有底物均可取得非常好的不对称催化效果( 最高98%收率、7 ∶ 1 dr 和99% ee)。与上述反应相似,该反应的非对映选择性依然稍差,最高只能得到7 ∶ 1 dr( 图14)[24]。值得注意的是,在较低催化剂(0.5 mol% ) 用量时,该反应还可以放大到克级规模(1.07 g 环状共轭N- 磺酰亚胺),依然能高收率高对映选择性的获得目标产物(86%,90% ee)。
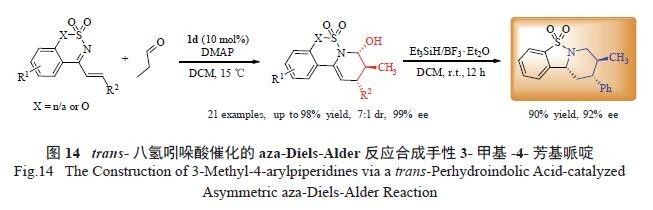
可以发现,上述反应过程都经过了α,β- 不饱
和亚胺与简单醛的不对称aza-Diels-Alder 关键步骤。我们设想,可能该协同反应过程中,产物的绝对构型难以控制,导致了产物极高的对映选择性但较差的非对映选择性。于是,我们希望通过反应底物的重新设计以及改变反应途径,来提高反应的非对映选择性。为此,我们开发了trans- 八氢吲哚酸等催化剂催化的环状N- 磺酰亚胺和α,β- 不饱和醛之间的不对称串联反应( 图15)[25]。研究表明,几乎所有反应都可以顺利进行,产物最高可获得93%的分离收率、大于20 ∶ 1 dr 的非对映选择性以及99.7% ee 的对映选择性。催化产物也可经一系列转化,例如通过还原或者氧化羟基,得到具有生理活性的氮杂环化合物—— 哌啶类或内酰胺类化合物,为这些化合物的合成提供一条简便有效的途径。
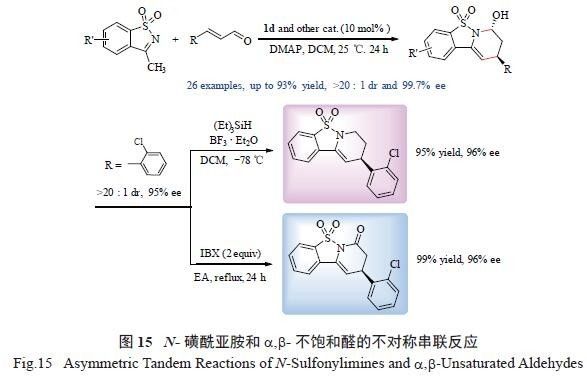
结合单晶试验确定产物的绝对构型以及不对称
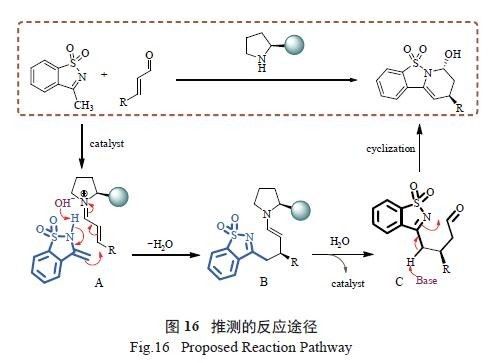
催化反应的试验数据,推测该反应经历了与上述反应不同的历程。首先,催化剂与一分子α,β- 不饱和醛反应得到亲电的亚胺中间体A。同时环状磺酰酮亚胺在碱性条件下发生互变,由亚胺互变为亲核的烯胺中间体。然后,烯胺中间体作为亲核试剂与亚胺中间体A 发生Michael 加成反应形成中间产物B。B 在水分子作用下水解形成中间体C。最后,C 经进一步环化得到最终产物,同时释放出催化剂进行下一个循环( 图16)。可以发现,由于反应机理不同,导致了反应产生不一样的非对映选择性。
2.5 trans- 八氢吲哚酸在不对称串联反应中构建氮
杂三骈环类化合物
前述工作成功地解决了简单脂肪碳环、氧杂
环以及氮杂环化合物的合成。接着,trans- 八氢吲哚酸被应用于氮杂稠环化合物的合成之中。设计了trans- 八氢吲哚酸催化的环状α- 脱氢氨基酮和简单醛的不对称串联反应,以构建手性氮杂三骈环类化合物。试验表明,几乎所有的底物均可取得高效的不对称催化效果( 最高94%收率、20 ∶ 1 dr 以及99% ee)( 图17)[26]。
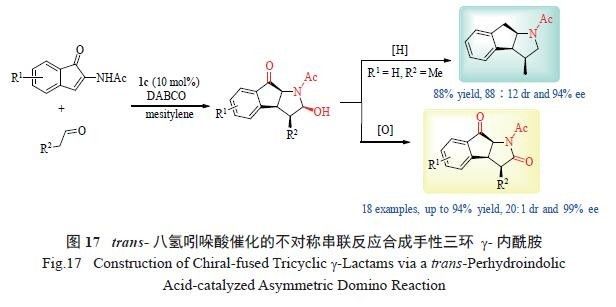
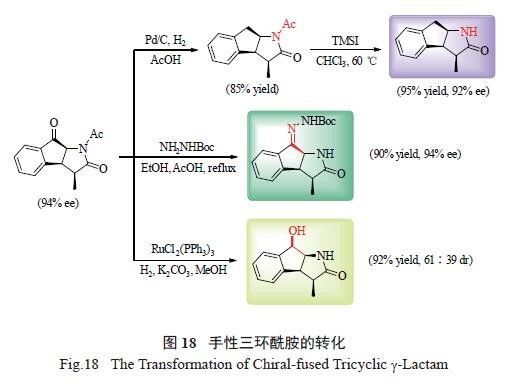
所得的三环内酰胺产物,可以方便地衍生成
许多具有生物活性的其他氮杂环化合物。①不对称催化产物经Pd/C 催化氢化,可选择性脱去中间环上的羰基,以85%的收率得到N- 保护的三环内酰胺。该内酰胺再在三甲基碘硅烷(TMSI) 的作用下,于氯仿中脱去乙酰基,得到N- 不保护的三环内酰胺。反应过程中,产物的对映选择性未受影响。②不对称催化产物又可以在乙醇中和肼基甲酸叔丁酯
(NH2NHBoc) 缩合得到手性腙类化合物。③该催化
产物还可以在RuCl2(PPh3)3 催化下发生催化加氢反应,选择性地还原酮羰基为羟基,得到手性氨基醇类化合物。该氨基醇类化合物可作为手性药物的骨架或手性有机小分子催化剂( 图18)。
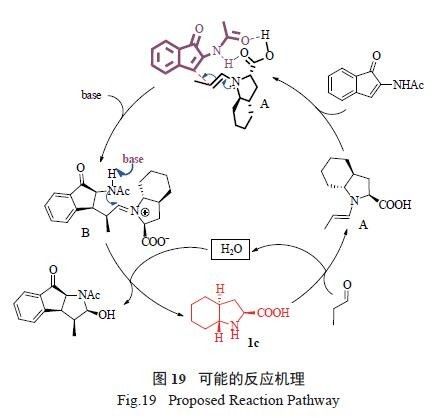
结合产物的绝对构型和具体试验结果,推测反
应可能经过以下过程( 图19) :首先,催化剂1c 与一分子丙醛作用,生成亲电的烯胺中间体A。然后,另一个原料烯酰胺与A 中的羧基由于氢键作用而相互靠近。在1c 中六元骈环位阻的影响下,烯胺中间体A 从烯酰胺的上方进攻发生加成反应形成中间体B。在碱的作用下,中间体B 中酰胺对亚胺正离子进行亲核加成,所得的中间体经水解生成稠氮杂三环产物,同时释放出催化剂1c。这些试验结果再次显示,trans- 八氢吲哚酸结构中的刚性六元骈环及2 个反式桥头氢是其在不对称催化中取得优异催化效果的必要条件。
3 结果与展期
在抗高血压药群多普利的开发过程中,我们探
索了其关键中间体1a 的高效合成工艺。从关键问题反式桥头氢的构建为出发点,选择以化合物2 为原料,仅经过4 步反应,即以49%的高收率得到全反式结构的trans- 八氢吲哚酸rac-1。再经过重结晶和手性拆分等过程,即以14.8%的总收率得到群多普利关键中间体1a( 图20)。
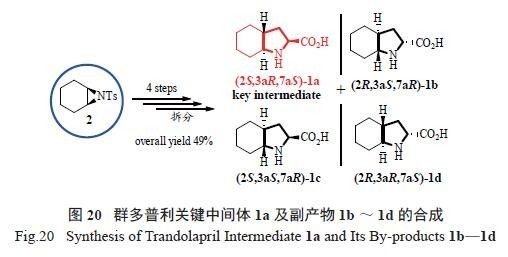
在拆分出1a 的过程中,同时也得到了其他3
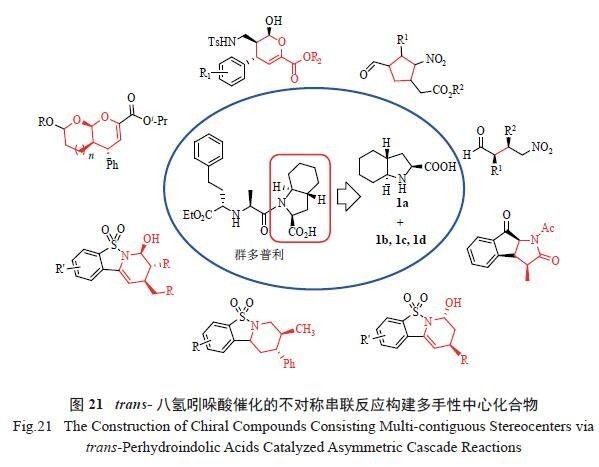
个副产物(1b ~ 1d)。从原子经济学角度考虑,如何将副产物1b ~ 1d 转化或再利用则成为一个挑战。但从另一方面来看,这些trans- 八氢吲哚酸的结构比较独特:在基于脯氨酸的基本骨架上,还拥有1个刚性的六元骈环及2 个反式结构的桥头氢。这些结构上的优势使得trans- 八氢吲哚酸在许多不对称催化中表现出极好的催化效果。作为比较,trans-八氢吲哚酸(1a ~ 1d) 首先被应用于经典的模板反应,简单醛与硝基烯烃的不对称Michael 加成反应中。在仅利用2 ~ 5 mol%催化剂用量时,反应取
得高达99%收率、99 ∶ 1 dr 和98% ee 的高效不对
称催化效果,远高于脯氨酸及常见的脯氨酸类手性小分子催化剂。于是,trans- 八氢吲哚酸被应用于一系列不对称串联反应,成功构建出种类多样的多手性中心脂肪环状化合物、氧杂环化合物以及氮杂环化合物。本研究工作不仅为血管疾病药物群多普利的高效合成提供帮助,而且为几例不对称催化反应提供了结构独特、来源方便且高效的手性脯氨酸类小分子催化剂( 图21)。
尽管脯氨酸作为有机小分子催化剂可用于多种
不对称催化反应,然而其本身直接作为催化剂却往往不尽如人意。在不对称催化反应中应用最多的是将其中羧基官能团转化成适当的位阻基团。如需要保留脯氨酸结构而对骨架进行改变,合成难度特别大,且也很难取得理想的不对称催化效果[27—31]。trans- 八氢吲哚酸在基于脯氨酸的基本骨架上,还拥有1 个刚性的六元骈环及2 个反式桥头氢。这些结构因素使其在不对称Micheal 加成反应,特别是在基于Micheal 加成的不对称串联反应中取得了高效的不对称催化效果。加之方便易得的特点,trans- 八氢吲哚酸将被应用于更多的新型不对称催化串联反应中,为多手性中心杂环类化合物的构建提供高效的途径。
基金项目:国家自然科学基金(21372152、21232004)
作者简介:刘德龙(1970—),博士、副研究员,主要从事手性药物
不对称催化合成研究。
Tel:021-34207176
E-mail:[email protected]




