
血脑屏障是大脑为保护中枢神经系统免受伤害而形成的一个重要进化机制,遗憾的是,它同样也是治疗药物进入大脑内部的一个主要障碍。
近期,来自于哈佛大学医学院的研究小组发现,ω- 3脂肪酸在保护血脑屏障稳定性中发挥着至关重要的作用。它能够保护中枢神经系统免于血缘性细菌、毒素及其他病原体。同时,他们找到了突破血脑屏障的关键蛋白。相关研究成果于5月3日发表在《Neuron》期刊。
这一研究成果由哈佛医学院神经生物学副教授Chenghua Gu带领团队完成。他们首次揭示了通过抑制转胞吞作用(transcytosis)维持血脑屏障稳定关闭的分子机制。转胞吞作用是一种通过囊泡在细胞间运输分子的特殊过程。研究团队发现,这一作用过程会被中枢神经系统血管细胞中的脂质抑制。
Mfsd2a蛋白
血脑屏障由中枢神经系统血管内皮层细胞构成。这些细胞紧密相连形成网络,阻止大多数分子在细胞间传递,包括多种针对大脑疾病的药物。
早在2014年,Chenghua Gu团队就曾在《Nature》期刊发表文章揭示,Mfsd2a蛋白能够抑制转胞吞作用,从而参与维护血脑屏障稳定。动物模型试验证实,Mfsd2a蛋白不表达或者活性降低,小鼠血脑屏障细胞之间会形成较多的囊泡,从而导致血脑屏障“泄露”,即便其构成细胞依然紧密相连。
Mfsd2a是一种转运蛋白,负责运输DHA进入细胞膜。DHA(二十二碳六烯酸)是一种ω-3脂肪酸,多存在于鱼油、坚果中。
ω-3脂肪酸+Mfsd2a蛋白:维持血脑屏障的关键
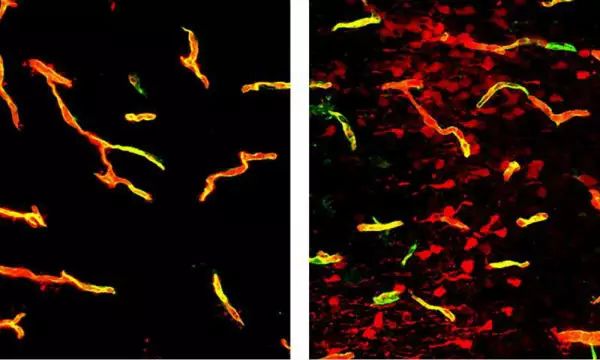
左图:正常的大脑血管,荧光染料并未外渗;右图:血管中不表达Mfsd2a蛋白,血脑屏障出现“泄漏”。(图片来源:哈佛医学院)
现在,Chenghua Gu带领学生Benjamin Andreone以及其他成员深入研究Mfsd2a维持血脑屏障稳定的具体机制。
为了监测这一蛋白对于血脑屏障的重要性,研究团队构建了Mfsd2a突变小鼠。因为Mfsd2a突变,它们运输DHA的能力会降低。他们给突变小鼠注射荧光染料,便于观察血脑屏障的渗透情况。
结果显示,这些突变型小鼠血脑屏障存在泄漏,且囊泡形成率、转胞吞反应频率较高。
研究团队比较肺部毛细血管内皮细胞(不存在屏障属性、不表达Mfsd2a蛋白)和大脑毛细血管内皮细胞的脂质成分,结果显示,相比于肺部内皮细胞,大脑内皮细胞内DHA的水平高出2-5倍!
此外,一系列研究表明,Mfsd2a蛋白会通过抑制胞膜窖(caveolae,一种通过细胞膜内陷形成囊泡的过程),实现转胞吞作用的限制。他们发现,当Cav-1蛋白(胞膜窖必需蛋白)正常表达、Mfsd2a蛋白不表达时,小鼠血脑屏障存在缺陷;当Cav-1蛋白、Mfsd2a蛋白都不表达,血脑屏障功能稳定。
对此,Chenghua Gu教授总结道:“我们认为,借助于DHA,Mfsd2a蛋白能够从根本上改变细胞膜的组成,使其避免形成不利于血脑屏障稳定的细胞膜内陷。”
通过揭示Mfsd2a蛋白功能以及验证它参与中枢神经系统转胞吞作用的过程,Chenghua Gu团队希望能够为打开血脑屏障、促成药物运输提供线索。目前,他们正在研究一种暂时封锁Mfsd2a蛋白功能的抗体。他们能够借此找到药物穿透血脑屏障的良策,从而实现一系列疾病的治疗,包括中风、老年痴呆症。
参考资料:1)Study reveals the surprising role of omega-3 fatty acids in keeping the blood-brain barrier closed
本文系生物探索原创,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源生物探索。
















