抗体相关类型可以大致分为5类:
单特异性抗体;多特异性抗体;Fc融合蛋白;抗体融合蛋白;和其他。
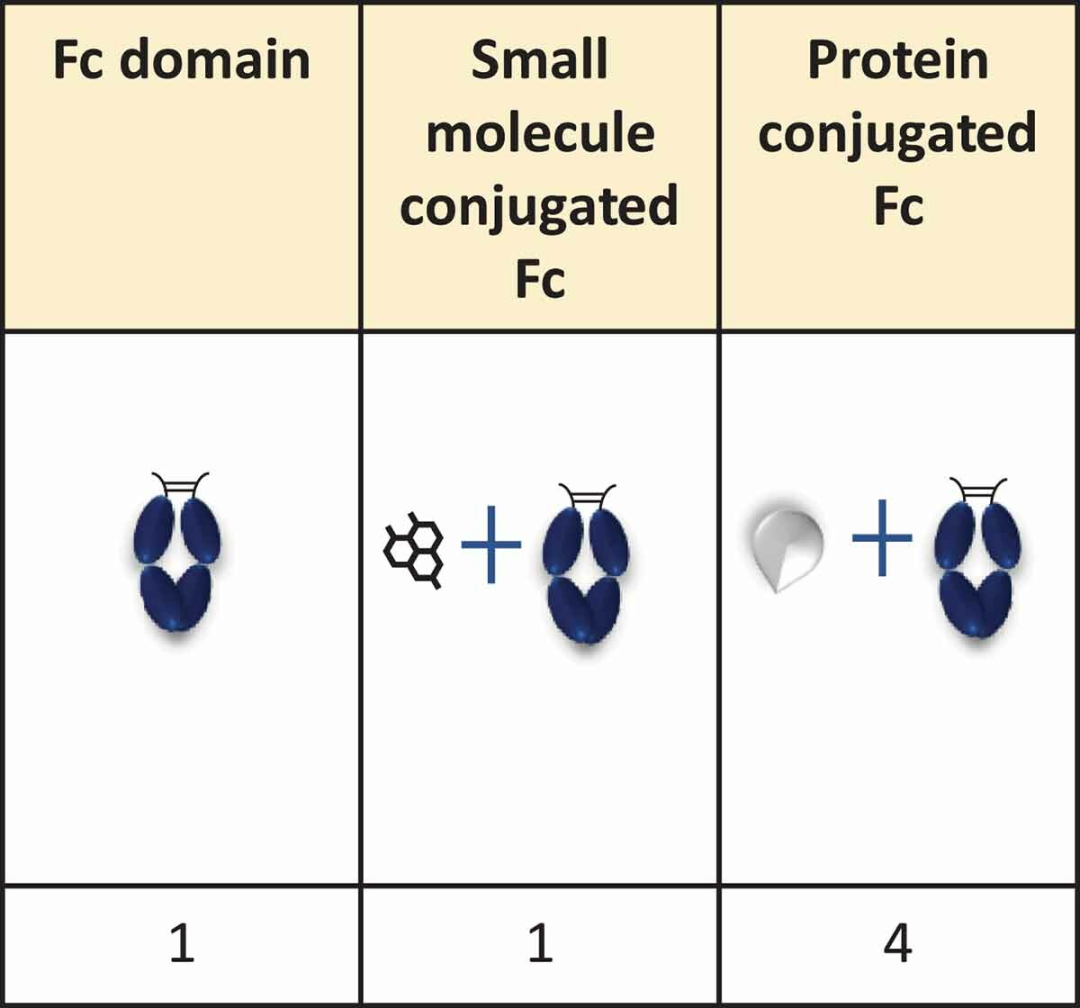
五类抗体结构如下:
(注:第一、第二、第三或第四抗原的可变结构域分别为黄色、橙色、红色和紫色;恒定结构域为深蓝色;利用异聚突变或结构域交叉的不对称设计的一部分为青色和绿色;圆形箭头为包含结构域交叉的设计)
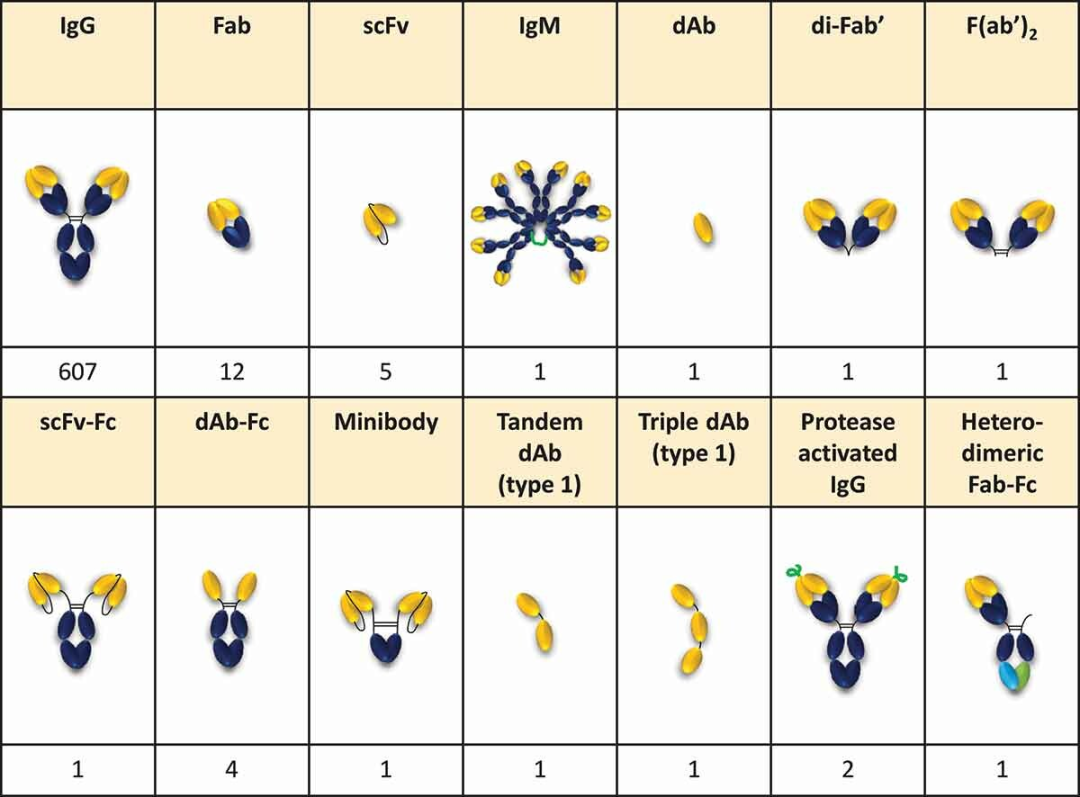
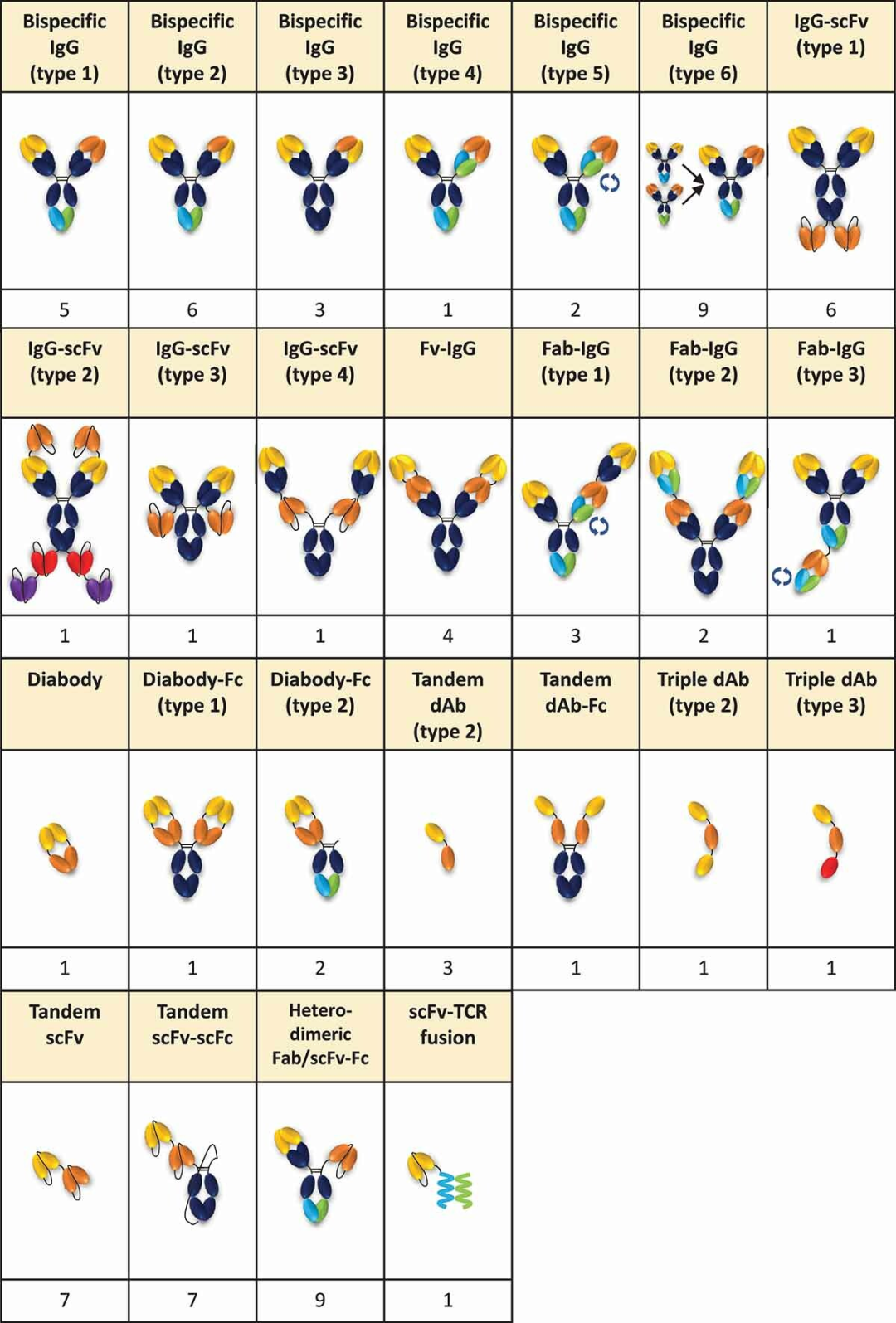
双抗
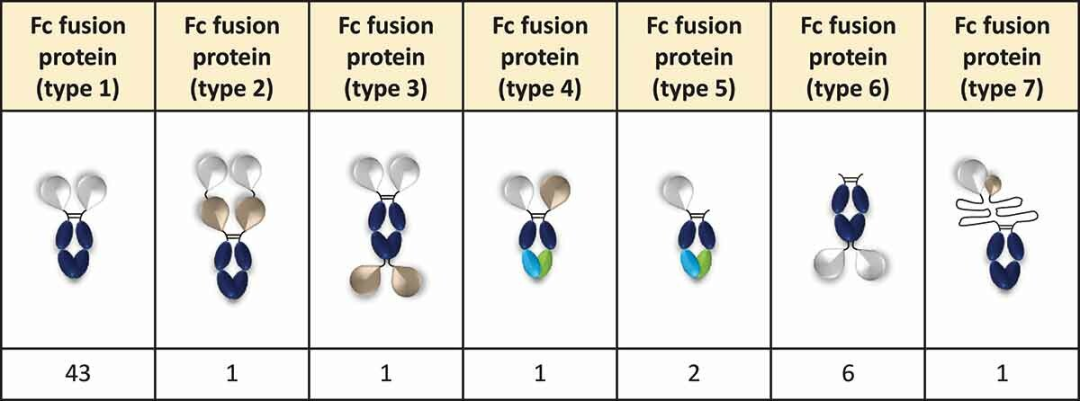
Fc融合蛋白

抗体融合蛋白
其他形式
抗体的结构决定其作用机制,其Fab段可以识别游离分子(VEGF、TNF等)靶点和细胞表面的受体(CD20、CD19等),决定抗体对外来入侵物如癌细胞等的特异性识别。
而Fc段决定抗体的效应功能,包括
抗体依赖的细胞介导的细胞毒性作用(ADCC)、抗体依赖性细胞介导的吞噬作用(ADCP),以及补体依赖的细胞毒性作用(CDC)。
ADCC
指抗体的Fab段结合病毒感染的细胞或肿瘤细胞的抗原表位,其Fc段与杀伤细胞(NK细胞、巨噬细胞、中性粒细胞等)表面的FcR结合,介导杀伤细胞直接杀伤靶细胞,是抗肿瘤的治疗性抗体药物发生作用的一种重要机制。
ADCC的三个基本成分是
效应细胞、抗体和靶细胞
。其中三种Fc受体可以结合IgG:
FcγRI(CD64)、FcγRII(CD3)和FcγRIIIA(CD16)
。
ADCP
与ADCC不同,ADCP由单核细胞、巨噬细胞、嗜中性粒细胞和树突细胞通过表达FcγRIIa(CD32a)、FcγRI(CD64)和FcγRIIIa(CD16a)来介导来吞噬疾病细胞,阻断研究表明,FcγRIIa是参与该过程的主要FcγR受体。
CDC
补体是存在于人或脊椎动物血清与组织液中的一组不耐热的,经活化后具有酶活性的蛋白质,包括30余种可溶性蛋白和膜结合蛋白。
抗体与补体C1q首先结合,接着C2-C9就被激活形成攻膜复合物对靶细胞发挥裂解效应。
很多抗肿瘤抗体都可以引起CDC作用,如抗CD20、CD52、CEA等抗体。
Fc工程化改造赋予抗体药物更强的肿瘤杀伤能力和免疫激活能力,近年来有不少研究聚焦于这个领域,相关改造有:
C1q介导的CDC改造
抗体
Fc段与C1q的6个球形头部接合,会启动血清中补体蛋白的蛋白水解级联反应,从而导致过敏毒素(如C3a和C5a)的释放以及在靶细胞表面形成膜攻击复合物,从而产生补体依赖的细胞毒性(CDC)。利用糖工程
对
Fc的N297残基进行糖基化
,有利于增强
FcγR和C1q的连接稳定性,提高CDC活性。而针对自身免疫性疾病,针对FcγR与C1q结合的特定残基L234F/L235E/P331S引入突变去糖基化,可以有效降低FcγR的亲和力,抑制CDC活性。
FcγR介导的ADCC/ADCP改造
FcγR具有影响抗癌抗体功效的潜力,当其与抗体Fc段结合后,可以激活抗体依赖的细胞毒性(ADCC)和抗体依赖的细胞吞噬作用(ADCP)。目前对Fc区功能的工程化突变主要集中在增强ADCC/ADCP的效应功能,其主要方式是提高Fc与激活性FcγR的结合能力。在技术策略上通过
氨基酸突变和糖基化修饰
来实现。
糖基化修饰主要通过N297位糖苷修饰时去除岩藻糖来实现。岩藻糖会通过空间位阻阻碍IgG与CD16A的最佳空间结合构象,去岩藻糖即可增强Fc与CD16A的结合能力,提高ADCC效应功能。

目前
突变
S239D/A330L/I332E是增强ADCC效应功能的核心方案;值得关注的另一种方案是采用VLPLL方案突变L235V/F243L/R292P/Y300L/P396L,使抗体在与FcγR结合选择中更具有针对性,从而增强ADCC效应功能
。

















