摘要
膀胱癌常侵犯盆腔脏器和腹主动脉、下腔静脉等主要血管,手术范围大,易发生难以控制的大出血。在膀胱癌根治术术前应充分准备红细胞(
red blood cell
,
RBC
)、新鲜冰冻血浆(
fresh frozen plasma
,
FFP
)和冷沉淀(
cryoprecipitate
,
Cryo
),如果预计出血≥
3
倍血容量(
60~75 mL/kg
),则还应准备血小板(
PLT
),以应对可能发生的大出血情况。大出血时欧美指南均建议按
1:1:1
(
RBC
:
FFP
:
PLT
)大量输血方案(
massive transfusion protocols
,
MTP
)输注血液制品。由于担心恶性细胞全身转移,关于对肿瘤患者使用术中自体血液回收这一技术,大多外科医师和麻醉医师持否定态度。是否应使用术中自体血液回收技术,目前尚无定论。大出血时易并发凝血功能障碍时,需及早干预,尽可能利用现有的血液制品和药物,维持凝血功能,以保障手术的顺利进行。
1. 病例介绍
患者男,43岁,身高175 cm,体重63 kg,血型AB型。
入院诊断:膀胱恶性肿瘤,右肾重度积水,右肾无功能。拟行开放性根治性膀胱全切、根治性右肾输尿管全切术。
既往无高血压、糖尿病、冠心病病史,心肺功能正常。
血常规尚正常,血红蛋白(Hb)98 g/L,血小板(PLT)20.3万/dL。凝血功能: 凝血酶原时间(PT)13.1 s(参考值:13 s),活化部分凝血活酶时间(APTT)29.6 s(参考值:30 s),国际标准化比值(INR) 1.00(参考值:0.8~1.14),纤维蛋白原(FIB)4.24 g/L(参考值:2~4 g/L), 凝血酶时间(TT)12.5 s(参考值:12.5 s)。术前尿常规:红细胞(red blood cell,RBC)4937/μL(参考值:0~15/μL),白细胞198/μL(参考值:0~15/μL)。生化指标:血尿素(blood urea nitrogen,BUN)5.29 mmol/L(参考值:3.00~7.20 mmol/L),肌酐(creatinine,Cr)100 μmol/L(参考值:44~133 μmol/L),总蛋白 55.5 g/L(参考值:60~85 g/L),白蛋白30 g/L(参考值:35~55 g/L)。
2. 麻醉管理
2.1 术前评估
2.1.1 实际麻醉前评估
既往无高血压、糖尿病、冠心病病史,心肺功能可, 美国麻醉医师学会(ASA)分级Ⅱ级,常规安排手术。
2.1.2 麻醉前评估分析
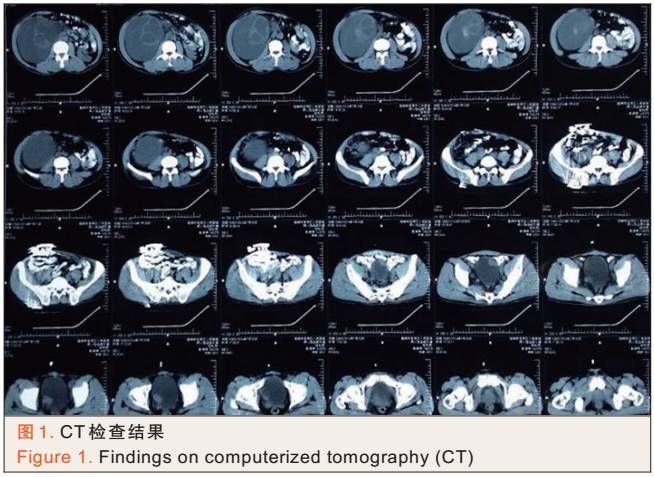
患者腹部计算机体层摄影(CT)检查结果如下:右肾重度积水,腹腔内有巨大包块(见图1)。
以下因素可能导致患者术中大出血[1]:
① 恶性膀胱肿瘤与盆腔组织和血管粘连,分离时有可能出血较多;行膀胱癌根治术需清扫盆腔淋巴结,这可能会切断血管导致大出血;
② 右肾重度积水,长期尿液外渗,在周围引起炎性反应、组织增生,增生组织与腹腔的组织与血管粘连,术中有可能大出血;
③ 需切除膀胱和右肾,手术创面大,渗血较多。
术前应充分准备RBC,新鲜冰冻血浆(fresh frozen plasma,FFP),冷沉淀(cryoprecipitate,Cryo)。如果预计出血≥3倍血容量(60~75 mL/kg),则还应准备PLT。
由于担心恶性细胞全身转移,关于对肿瘤患者使用术中自体血液回收这一技术,大多外科医师和麻醉医师持否定态度。是否应使用术中自体血液回收技术,目前尚无定论[2]。本例患者术前尿常规白细胞198/μL,可能存在泌尿系统感染,又存在膀胱恶性肿瘤,故不准备使用自体血液回收技术。
2.2 术中管理
2.2.1 麻醉诱导
患者入室后予吸氧,监测心电图和脉搏血氧饱和度,局部麻醉下行左侧桡动脉穿刺置管测量有创动脉压。诱导前输注完500 mL晶体液,使用快速顺序诱导全身麻醉,予舒芬太尼30 μg、咪达唑仑2 mg、丙泊酚80 mg、国产罗库溴铵40 mg诱导插管。
2.2.2 麻醉诱导分析
患者右肾重度积水,仰卧位时,包块压迫下腔静脉,回心血量减少;术前禁饮、禁食,血容量轻度不足;麻醉药物扩张血管,减少心排量,三者叠加,可导致血压明显降低。监测有创动脉压后再开始麻醉诱导,以及时发现低血压;诱导前输注完500~1000 mL的液体;准备好升压药物;这些均有必要。
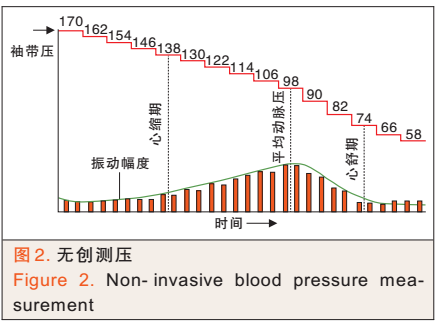
对测量血压袖带充气加压时,动脉搏动会产生振动。监护仪无创测压是指,通过测量压力改变时动脉振动幅度的变化来测量血压(见图2)。心排量降低时,动脉振动幅度的变化变小,严重时甚至测不到,这时监护仪无创测压不准确,应通过动脉穿刺置管测量有创动脉压[3]。
手术操作时,可能会损伤血管导致大出血,故应在双上肢开通静脉,以保证快速输液时有足够的通道。行右颈内静脉或右锁骨下静脉穿刺置管,以监测中心静脉压力,同时在上腔静脉提供一个快速输液通道。
2.2.3 术中管理
手术开始后顺利,生命体征平稳,手术进行1.5 h后,外科医师操作时弄破患者下腔静脉,30 min内失血量达3000 mL,心率(HR)160次/min,动脉压(ABP)58/34 mm Hg(1 mm Hg=0.133 kPa),中心静脉压(CVP)由8 mm Hg降至3 mm Hg。立即再在上肢开通另一静脉通道,经3个静脉通道快速输注羟乙基淀粉(HES)130/0.4和乳酸林格氏液,同时在保温箱加温一批胶体和晶体,输注液体均需加温到38~39℃。经中心静脉泵注去甲肾上腺素1~3 μg·kg-1·min-1,血压低时,间断推注肾上腺素0.5~1 mg。
因是恶性膀胱肿瘤,且包块切开时有坏死组织,未使用自体血液回收技术。
联系输血科准备RBC和FFP,被告知已备好的血液制品已用于昨晚急诊手术患者,AB型FFP已用完,昆明市中心血库也无AB型FFP,RBC仅有2000 mL,Cryo仅有30 U,PLT无。因为血荒,手术当天无更多的血液制品。
取AB型RBC 2000 mL和Cryo 30 U至手术间备用,在外科医师缝住下腔静脉破口前暂不输注RBC和Cryo,继续快速输注加温的HES 130/0.4和晶体液,以人工胶体为主。维持收缩压(SBP)在80 mm Hg左右。监测体温,使用热风机对患者进行保温,体温维持在 35.2~36.5℃。静注血凝酶1 KU,在患者家属签署大剂量氨甲环酸(tranexamic acid,TXA)使用同意书后,为患者持续泵注大剂量的TXA, 100 mg/kg负荷量半小时内泵完,随后以10 mg·kg-1·h-1剂量持续泵注,直至术毕。外科医师缝住下腔静脉破口后,输注AB型RBC 2000 mL和Cryo 30 U,再静注血凝酶2 KU,维持CVP在6~8 mm Hg,输注RBC和Cryo时,静注呋塞米10 mg,以避免快速输注血液制品而导致容量超负荷。随着出血止住,逐步减小去甲肾上腺素剂量,ABP维持在100~120/60~80 mm Hg。输注RBC前进行动脉血气分析:酸碱度(pH)7.06,动脉血氧分压(PaO2)346 mm Hg,动脉血二氧化碳分压(PaCO2)33 mm Hg, 碱剩余(BE)-19.3 mmol/L,乳酸10.3 mmol/L,离子钙0.67 mmol/L(正常值:1.15~1.35 mmol/L),血细胞比容低于15%,血气分析仪测不出Hb,给予5%碳酸氢钠300 mL静脉输注{补给量计算公式:补5%碳酸氢钠(mL)=[BE绝对值×体重(kg)/4]} [4],葡萄糖酸钙2 g静滴。手术快结束时,总出血量8000 mL,经容量复苏后HR 90~100 次,ABP 110~130/60~80 mm Hg,CVP 6~8 mm Hg,停用所有升压药物。总输液量10100 mL,其中HES 130/0.4 6000 mL,乳酸林格氏液1500 mL,RBC 2000 mL, Cryo 600 mL;总出量10000 mL,其中失血量8000 mL,尿量2000 mL。
手术结束时带气管导管送入重症监护治疗病房(ICU),生命体征平稳。血常规检查:Hb 6.3 g/dL,PLT 7.5万/dL;凝血功能:PT 37.3 s(参考值:13 s), APTT 53.6 s(参考值:30 s), INR 2.99,FIB 1.6 g/L(参考值:2~4 g/L),TT 13.0 s(参考值:12.5 s), D-二聚体 2.2 μg/mL(参考值:0~1 μg/mL);生化指标:总蛋白21.5 g/L(参考值:60~85 g/L),白蛋白6.5 g/L(参考值:35~55 g/L),BUN 2.9 mmol/L(参考值:3.00~7.20 mmol/L),Cr 93 μmol/L(参考值:44~133 μmol/L)。
2.2.4 术中管理分析
2.2.4.1 关于容量治疗
大出血时,容量复苏应以胶体为主。当时全省白蛋白紧缺,输注白蛋白的申请单需要院长签字,最终无法获取白蛋白。所以容量复苏时只能以人工胶体为主。科室主要胶体是HES 130/0.4,且分子量为14万道尔顿,最大,不易渗透到毛细血管外,特别是肺循环的毛细血管,其通透性比体循环的毛细血管要高,如果大量输晶体很容易导致肺水肿。大出血时白蛋白快速丢失,本例患者的白蛋白由30 g/L降至6.5 g/L,血管内胶体渗透压主要由白蛋白产生,如此低的白蛋白导致胶体渗透压很低,血管内容量很难维持,故需以补充人工胶体为主。未选择琥珀酰明胶基于二种顾虑:过敏反应,失血性休克叠加过敏性休克,后果是灾难性的,HES 130/0.4的过敏性反应几率很低;琥珀酰明胶分子量4万道尔顿,有可能漏出到肺循环毛细血管外,增加肺水肿几率。
HES 130/0.4使用量达6000 mL,超过说明书使用量。在血管破裂出血的时候,HES 130/0.4从破裂的血管流出,不从肾脏排出,而且在危急时刻,不保障心脏前负荷患者就可能发生心跳骤停[5,6]。有研究者认为HES 130/0.4会加重肾损伤[7,8],2012年的严重脓毒症和感染性休克管理指南反对将HES 130/0.4用于严重脓毒症和感染性休克的患者[9]。也有新的研究证明,对于存在低血容量休克的危重患者,与晶体相比较,HES 130/0.4并不增加肾损伤和28天死亡率,且胶体组的循环更稳定,呼吸机支持时间更短,90天死亡率低于晶体组[10]。在大出血时,血液制品有限,白蛋白无库存,仅能靠人工胶体维持血容量,先应维持生命,再考虑保护肾功能。
2.2.4.2 关于血液制品的输注
本例患者手术时昆明市正处于血荒期,AB型RBC仅有2000 mL,Cryo 30 U,其他的血液制品均无。RBC和Cryo有限,应仔细斟酌使用时机。在外科医师未缝住血管破口时输注血液制品,血液制品只会白白丢失掉,且再无法获取更多的血液制品。因此,在外科医师缝住血管破口前,暂不输注RBC和Cryo,先以人工胶体维持容量。
在麻醉状态下,全身氧耗量降低,短时间内Hb很低不会导致患者死亡。笔者曾数次处理大出血的患者,1~2 h内Hb仅有3 g/dL左右,但患者最终存活。
大出血时,以下因素易导致急性凝血功能障碍[11-13]:
① 稀释:大量输液稀释凝血因子和PLT浓度,会导致凝血功能障碍;
② 低体温:大量输入低于体温的液体,手术室温度低等因素均会导致患者低体温,低温时凝血块的生成速度会变慢。体温低于33℃时,凝血功能会受到明显影响,且会出现临床出血征象。管理本例患者时,已尽可能保持体温,改善凝血功能;
③ 酸血症:酸血症会影响凝血酶的功能,但在临床中很难将酸血症和休克与组织低灌注对凝血功能的影响相区别。在动物实验中,当pH为7.1时,PT和APTT延长20%。也有研究者在动物实验中发现,仅纠正酸中毒并不能逆转PT和APTT的延长。酸血症的影响尚有争论,但对于本例患者,仍给予碳酸氢钠纠正酸中毒,以减少对凝血功能的可能影响。严重的酸中毒也会导致外周血管对血管收缩药物不敏感。
④ 消耗:手术时组织因子激活外源性凝血通路。大出血时毛细血管内皮细胞受损,暴露出组织因子,组织因子大量结合Ⅶ因子,激活外源性凝血通路。毛细血管内皮细胞受损后,也暴露出Ⅲ型胶原,Ⅲ型胶原大量结合血管性血友因子(vWF)和PLT。
大出血时微循环低灌注还通过以下二种机制导致急性凝血功能障碍[3]:
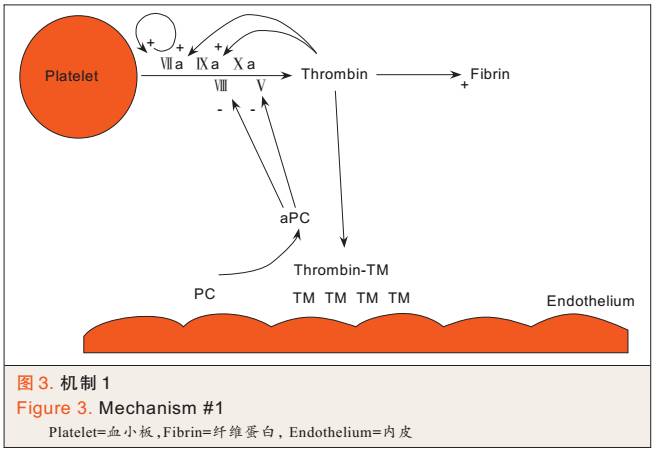
① 蛋白C激活增加全身抗凝系统的活性:组织低灌注时,血管内皮细胞释放血栓调节蛋白(thrombomodulin,TM),TM和凝血酶(thrombin)结合,进而妨碍凝血酶将纤维蛋白原裂解为纤维蛋白。TM和凝血酶的复合物还可激活蛋白C(activated protein C,aPC),进而抑制V 和 VIII因子,最终减少凝血酶的生成(见图3)。
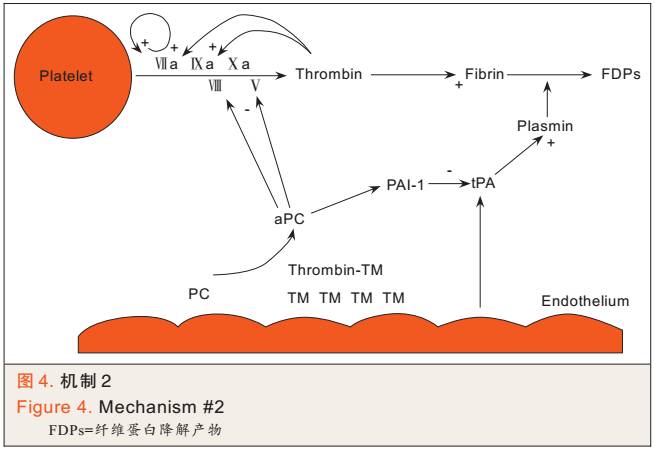
② 纤溶系统过度亢进:组织低灌注时,血管内皮细胞释放组织型纤维蛋白溶酶原(tissue plasminogen activator,tPA ),tPA裂解纤维蛋白溶酶原(plasminogen),启动纤溶系统。TM和凝血酶的复合物激活aPC,aPC消耗纤溶酶原激活物抑制因子-1(plasminogen activator inhibitor-1 ,PAI-1),PAI-1的减少导致tPA活性更高,最终导致纤溶系统过度亢进(见图4)。
对于大出血患者的凝血功能障碍,需尽早处理,ASA指南[14]规定PT大于1.5倍正常值,或INR达2.0,或APTT大于2倍正常值方需输注FFP;不能及时获得PT和APTT时,输注一个血容量后方可输注FFP以纠正凝血因子缺乏;输注量为10~15 mL/kg。规定FIB<0.8 g/L时方可输注Cryo。凝血功能检查结果的等待时间长,血栓弹力图方便快捷,但昂贵。ASA指南中对凝血功能障碍需纠正指征的要求不严格,欧洲的创伤出血管理指南[15]推荐APTT或PT大于1.5倍正常值时可输注FFP,输注量为10~15 mL/kg;若出血时FIB<1 g/L,则需输注Cryo。欧洲麻醉学会指南[16]推荐FIB<1.5~2 g/L时输注Cryo。笔者的临床研究表明,当失血量达到全身血容量的30%时,已符合输注FFP和Cryo的指征。当不能获得凝血功能检查结果和TEG,失血量达到全身血容量的30%时应考虑输注FFP和Cryo纠正凝血功能障碍。ASA和欧洲的指南均推荐PLT维持在5万/dL以上。大出血时欧美指南均建议按1:1:1(RBC:FFP:PLT)大量输血方案(massive transfusion protocols,MTP)输注血液制品[17],但目前在昆明市,血液制品短缺,医院经常因为血液制品缺乏而停止手术。需提前一天向中心血站预约PLT,但不能保证第二天肯定有PLT送至。如本例患者,临时申请PLT,无库存。笔者的临床研究显示,血液制品有限时,2:1或3:1(RBC:FFP)输注也可最低限度保持凝血功能。














