7月12日,诺华宣布,FDA肿瘤药物咨询委员会 (ODAC) 以10:0的投票一致建议FDA批准诺华CAR-T项目CTL019的上市,用于
幼儿或年轻成人复发或难治性B细胞急性淋巴细胞白血病
的治疗。如果获批,CTL019将成为全球首个上市的CAR-T细胞疗法,也是首个上市的基因治疗产品。
小编对诺华的这一成绩表示祝贺,因为这既是癌症免疫疗法的又一重大突破,又是合成生物学在药物研发上的一次成功应用,意义非凡。借此机会,小编梳理一下与CTL019研发相关的一些细节和事件,并尝试基于这些信息对CAR-T在国内外的前景做一个展望。
截至目前,临床在研的CAR-T项目涉及的靶点不在少数,至少有45个。其中,针对实体瘤(非血液系统)的靶点约有33个,针对血液系统癌症的靶点约有15个(部分重合)。CD19便是针对血液系统癌症的靶点之一。
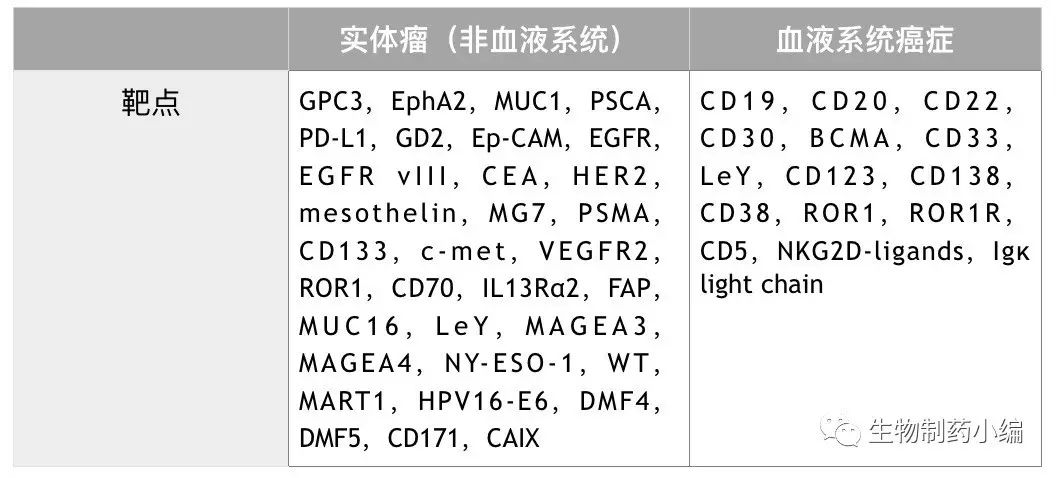
在ClinicalTrials.gov上以“CAR-T”为关键词,可以检索到约194项与CAR-T相关的癌症治疗试验。进行分析可以发现,以针对血液系统癌症的试验为主;而这些试验中,以CD19为靶点的试验有77个,占62.1%。虽是不完全统计,但可以看出,
CD19是目前CAR-T治疗的一个非常热门的靶点
。

CTL019的靶点也是CD19。Carl June在其文章里说,他们选择CD19作为最先研究的靶点,是基于3个原因:
这3点表明,CD19是治疗B细胞来源癌症的理想的靶点。也这正应为此,多年来,针对CD19的其他类型的药物研发也从未停止过。
这套CAR-T系统最早由St Jude儿童医院的Campana教授的实验室开发,2004年移交给宾夕法尼亚大学的Carl June教授继续研发。2012年,诺华和宾大达成协议,就这一技术技术的后续开发和商业化进行合作。
CTL019属于
二代CAR-T
,其CAR的胞内部分由共刺激信号区域4-1BB (CD137) 和CD3zeta构成。
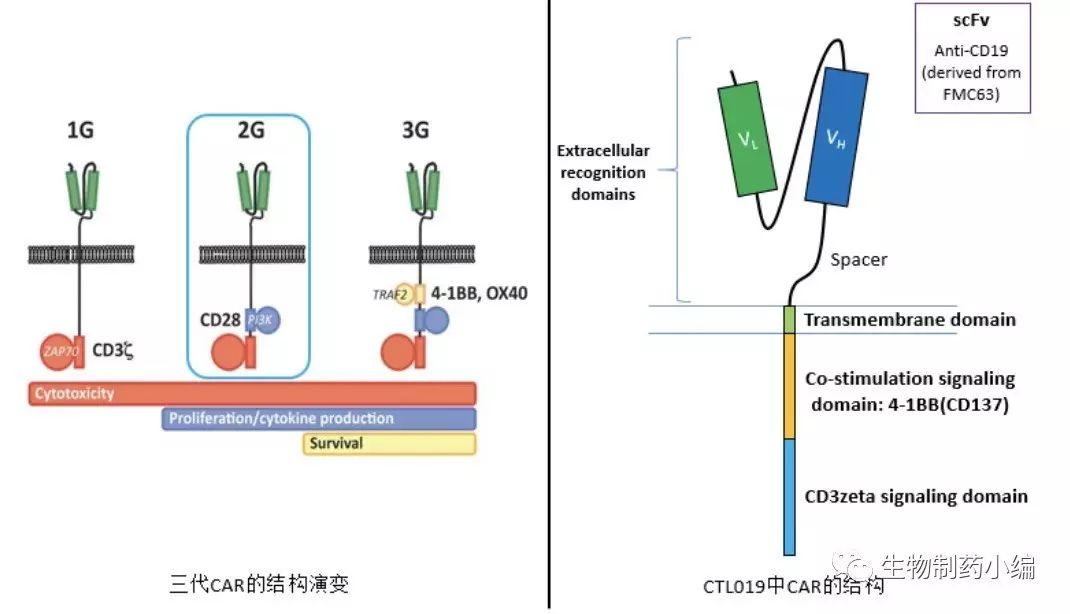
CAR中的scFv部分,序列的重链可变区和轻链可变区源于鼠杂交瘤细胞系FMC63,该细胞系可以生产鼠源抗CD19单抗。该scFv最早由澳大利亚的Arthur W. Hohmann的实验室从全抗改造而来,他们测得KD值为2.3x10
-9
。
具体序列如下:

其他部分,除了N端的信号肽MALPVTALLLPLALLLHAARP(源于CD8的α链N端信号肽)之外,即Spacer(CD8 Hinge & TM)、4-1BB和CD3zeta区域,专利公布的序列如下:

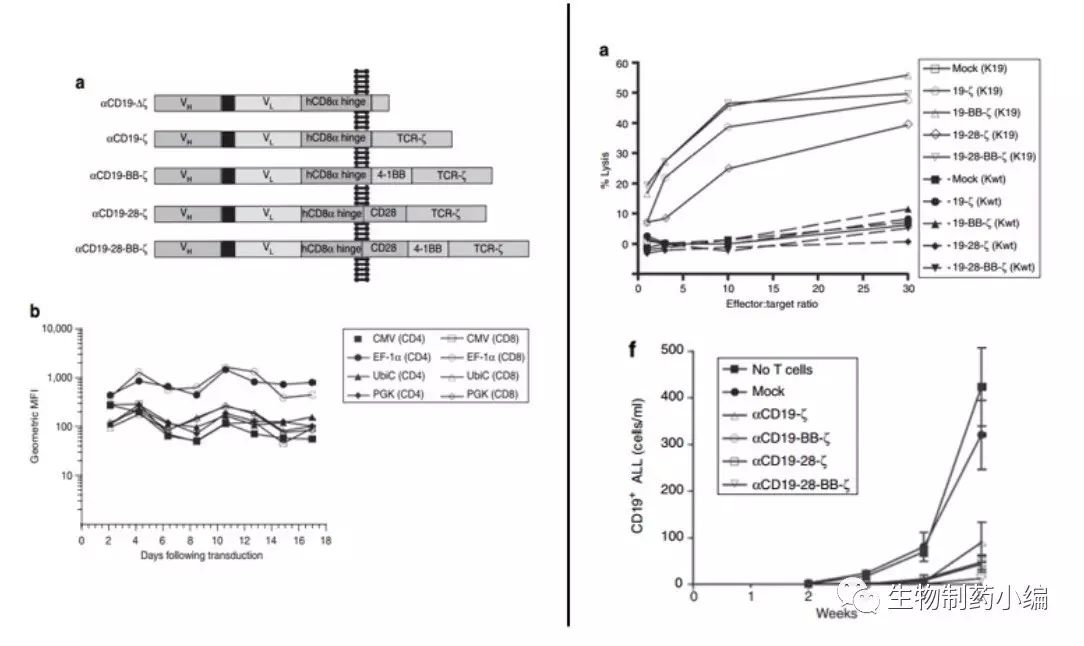
CAR的表达载体antiCD19scFv-41BB-CD3Zeta使用慢病毒核心载体,该载体是基于第三代“自我失活” (self-inactivation) 的慢病毒载体改造而来。
2003年,Carl June团队从Campana教授处获得改造好并已初步检测过效果的antiCD19scFv-41BB-CD3Zeta载体,开启后续的临床转化研究。2009年发表在Molecular Therapy上的文章中,June团队对载体中CAR的结构和启动子进行了优化,并将antiCD19CAR-T用到白血病细胞移植小鼠模型上,证实antiCD19CAR-T能在体外和体内很好地杀伤B细胞来源的急性淋巴白血病细胞。
关于慢病毒包装系统,专利上说是用3质粒包装系统,而Carl June的文献显示,实验使用的是第3代的4质粒包装系统。根据诺华在BLA申请时提交的CMC数据来看,慢病毒载体的生产实际使用的是4质粒包装系统:

CTL019所采用的病毒载体是由英国Oxford Biomedia公司的LentiVector@ 技术平台完成的,该平台即使用上述包装系统。2013年,诺华支付1400万美元委托Oxford Biomedia为其生产CTL019所采用的病毒。
2011年,发表在Science Translational Medicine上的文章报道,3个晚期慢性淋巴细胞白血病 (CLL) 经CART19 (即CTL019) 治疗后,有2个病人病情完全缓解,1个部分缓解。
2011年的另一篇发表在NEJM上的文章报道了一个患难治型CLL的病人,经低剂量的CART19细胞治疗后,病情获得完全缓解,且缓解时间达持续10个月以上。
2012年,患B-ALL的Emily Whitehead入组在费城儿童医院进行的CTL019(与诺华合作后项目名称为CTL019,项目由诺华领导)的临床试验,虽出现严重的细胞因子风暴,经历惊险时刻,但最终幸运地度过难关且最终治愈。
2013年,2例儿童复发难治型pre-B ALL病人经CTL019治疗后都获得了完全缓解,期间经历的细胞因子释放综合征,但通过依那西普和托丽珠单抗治疗被平息。其中一位病人缓解时间超过11个月,另一位病人在治疗2个月后复发,新出现的原始血细胞 (blast cell)的 C19表达缺失。该试验的相关情况发表在NEJM上。
2014年,June团队在NEJM上发表的文章报道了他们在费城儿童医院开展的30个人的规模的临床试验,证明CTL019细胞可用于治疗复发性ALL,病人的完全缓解率达到90%。
2015年,June团队在NEJM上报道了接受他们的治疗的最初14个患复发或难治型CLL的病人的成熟数据。14位患者的整体响应率为57% (8 of 14) ,其中4位完全缓解,4位部分缓解。最早完全缓解的2位患者体内CAR-T细胞的功能维持了4年以上,完全缓解的患者中没有人出现复发状况。
以上为公开发表的有关CTL019的数据。根据ClinicalTrials.gov公布的信息,目前已经完成和仍在进行的临床试验有15个,适应症主要为CD19阳性的复发、难治型的淋巴瘤或淋巴细胞白血病,骨髓瘤适应症也有少量涉及 (NCT02135406,NCT02794246) 。
而CTL019此次被建议批准的的适应症是幼儿或年轻成人复发或难治性B细胞急性淋巴细胞白血病,ODAC对它的信心是基于诺华领导的
ELIANA临床试验 (NCT02435849)
,一项涵盖25个试验点的国际多中心临床试验。
该试验数据显示,经治疗3个月后,83% (52 of 63) 的患者获得完全缓解或血细胞不完全恢复的完全缓解;6个月的无复发概率为75%,12个月的无复发概率为64%;6个月的生存率为89%,12个月的生存率为79%。
到目前为止,CTL019的临床试验遇到的毒副作用主要是细胞因子释放综合征和神经系统事件,包括在ELIANA试验中,47%的患者出现3级或4级细胞因子释放综合征,15%的患者出现神经系统问题。细胞因子释放综合征是细胞治疗最为常见的副作用,应对这一副作用,根据以往经验,可以通过药物进行辅助治疗,比如Emily在经IL6R抗体托利珠单抗治疗后体内细胞因子风暴被控制,最终康复。对于在神经系统产生的副作用,机制尚不清楚,好在CTL019没有像Juno的JCAR015和Kite的KTE-019那样出现患者因脑水肿死亡的案例,但这类情况仍需多加防范。
据诺华官网宣称,诺华已建成的位于新泽西的工厂Morris Plains已经为全球数百位病人的临床试验生产了CTL019,而基于这一套经验,诺华也在继续投资建设CTL019的生产设施。随着CAR-T产品的临床试验规模的扩大和试验地点的增多,如何在保证
安全性
、
质量
及
稳定性
的基础上实现CAR-T产品的扩大生产和多地点生产,这个问题已经需要立刻摆上会议桌。
今年3月份,宾大、Oxford BioMedica、诺华这3家机构联名在Molecular Therapy上发表文章,讨论CTL019细胞面向全球的大规模生产和应用所需要考虑的问题。

病毒载体的质量控制:
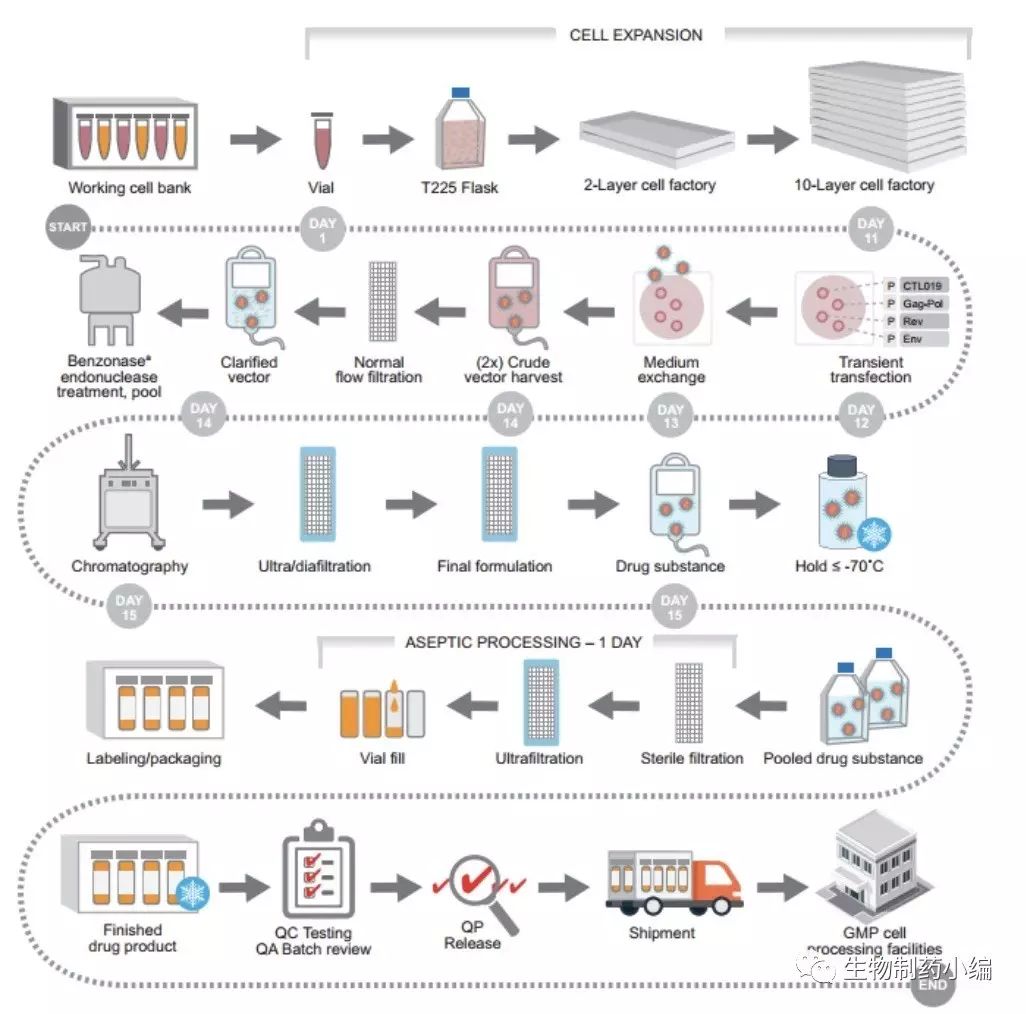
对于Oxford Biomedia来说,这是一项极具前瞻性的举措;而对于宾大和诺华来说,合理外包,是实现CTL019生产规模化和标准化的策略之一。
CAR-T细胞的生产和质量控制:
整个流程的每一环节均进行质控,以尽量减少产品效果的波动性。
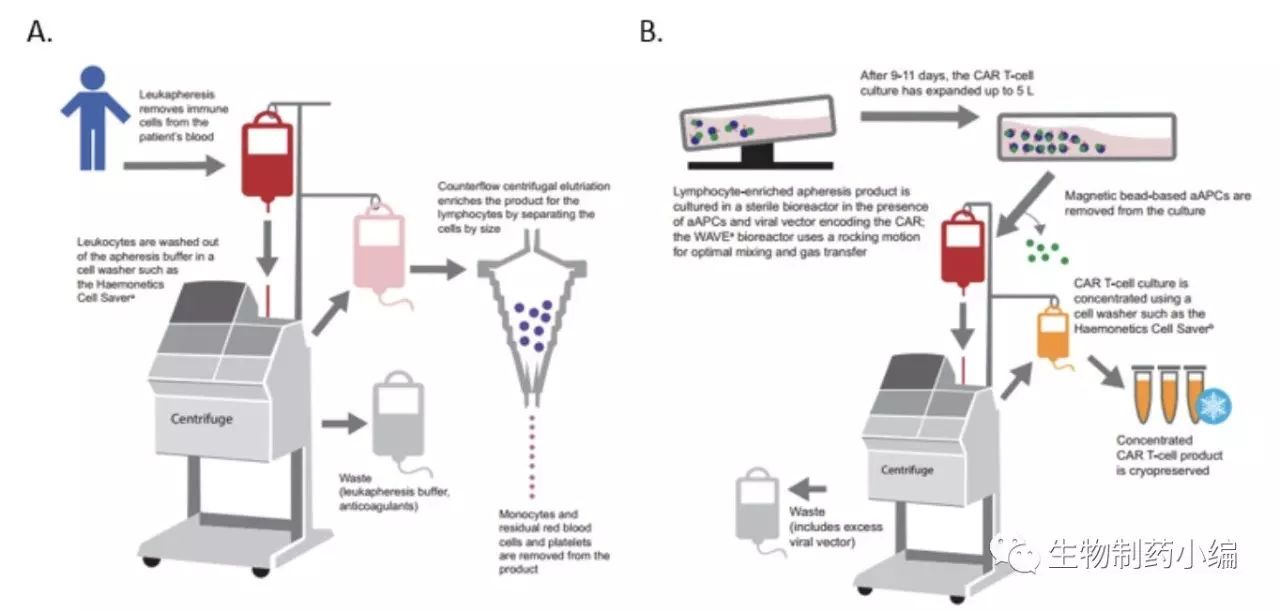
实现生产由小规模向大规模的转变,需要在原材料获取、产品生产、终端使用等各个环节实现严格的流程管理和质量控制,并实现各环节之间的协调运作。为整个流程制定一个标准化和详细的protocol并严格执行,是十分必要的。

另外,对于CAR-T产品的生产,还应考虑的一点是:
病毒载体的设计要与预计针对的适应症类型相匹配,生产规模要与预计的患者人群规模相匹配
。这样,才能实现产能上的协调。
同样在Global Manufacturing of CAR T Cell Therapy这篇文章中,作者们谈到了CTL019需要面对的法规问题。CTL019能否为各国家和地区的监管部门和相关法规所容纳,直接决定其能否实现全球多中心临床试验的开展和将来的全球销售。
CTL019将面对的法规阻力来自于两个方面:
每一款申请境外临床试验和上市的药品均会遇到,因为不同国家和地区对于药品临床试验和上市的申请,在流程上和具体内容上都会有或多或少的区别,这些需要企业事先做好详尽的法规研究。
对于这样的的细胞/基因治疗方法,美国以外的其他国家的监管机构还没有针对细胞治疗和基因治疗的完善法规,这可能会严重阻碍CAR-T产品在全球的迅速推广。2012年11月,巴西ANVISA、欧洲药监局等多个药监部门成立了协调小组,讨论如何有效管理细胞和基因疗法。
虽然人们在同时在做政策上的努力,但真正决定这一疗法能否被广泛接受的,还是它本身的安全性、有效性和标准化。要做到大规模和大范围的标准化,其实是很困难的。从血液收集、T细胞分离和获取、病毒制备、CAR-T生产、保存等各个环节,影响产品质量的因素太多,技术的标准化要求太过细致。另外,标准化的CAR-T产品是否真的具有普遍的适用性,还需更多的验证。因此,任重道远。
目前,多方在预测和探讨CTL019今后的合理治疗费用。今年年初,英国NICE认为,CAR-T疗法在儿童白血病治疗上的价值可达64.9万美元。而诺华日前也表示,CTL019的价格可参考干细胞移植的费用,该费用最高可达80万美元。
诺华对CTL019的定价策略正在制定当中,基于如此高昂的治疗费用,诺华考虑采用按疗效付费的方式,当然也不排除其他可行的方案。
由此可以看出,
CTL019属于一款私人订制的高端治疗方法
。
在国外资本对CAR-T技术趋之若鹜的同时,国内的CAR-T发展也日趋升温。科研和医疗单位如天津血液病研究所、三军大西南医院等,已经开启临床试验;企业如北大未名、博生吉、西比曼等,也在积极布局。
对于国内的发展,小编个人觉得,有两个方面是需要重点努力实现的,比靶点和CAR-T技术本身的创新更为重要:
目前国内对细胞治疗的性质还没有明确的分类,更没有详细的技术标准、操作指南和管理规章。而从前文诺华对CAR-T产品的生产管理的讨论即可看出,CAR-T细胞治疗是一项环节繁多、技术精细的流程,缺乏技术标准和合理的监管,将对该领域的发展造成严重制约。
从人们对CTL019的估值来看,大部分病人对该治疗方法是缺乏支付能力的,因此在我国现阶段医保覆盖有限、商业保险不成熟的现状下,布局CAR-T的企业和机构需要仔细考虑将来的市场推广问题。
总而言之,前途光明,路程漫长。
-
Ion C. Nicholson, et al. Construction and characterisation of a functional CD19 specific single chain Fv fragment for immunotherapy of B lineage leukaemia and lymphoma
-
CTL019的专利:US2013287748 (A1)
-
Tom Dull, et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System.
-
C Imail, et al. Chimeric receptors with 4-1BB signaling capacity provoke potent cytotoxicity against acute lymphoblastic leukemia
-
Michael C. Milone, et al. Chimeric Receptors Containing CD137 Signal Transduction Domains Mediate Enhanced Survival of T Cells and Increased Antileukemic Efficacy In Vivo.
-
Michael Kalos, et al. T Cells with Chimeric Antigen Receptors Have Potent Antitumor Effects and Can Establish Memory in Patients with Advanced Leukemia.
-
David L. Porter, et al. Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia.
-
Stephan A. Grupp, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia.
-
Shannon L. Maude, et al. Chimeric Antigen Receptor T Cells for Sustained Remissions in Leukemia.
-
David L. Porter, et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia.
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237














