▎药明
康德/报道
编者按:
本月初,美国FDA批准了阿斯利康(AstraZeneca)的Imfinzi(durvalumab)上市,治疗膀胱癌。很多人都注意到,这是美国FDA历史上批准的第五款PD-1/PD-L1通路的单克隆抗体(单抗)新药,但意识到它是今年第五款上市的单抗新药的人,可能就没有那么多了。自2015年以来,美国FDA已经批准了20多款抗体新药,这也说明在当下这个时代,抗体药物将起到越来越重要的作用。今日,我们结合行业知名博客LifeSciVc的资讯,为大家回顾一路以来,抗体药物在生物技术与医药行业内的发展故事。
那些熟知行业研发生产率的资深人士们一定知道,抗体药物的表现远优于药物平均水平。
2014年,《Nature Biotechnology》发布了一篇详细的综述,探讨了临床药物的研发成功率。大量数据表明,小分子新药获批通过IND的成功率约为7.6%,而单抗新药的成功率约为14.1%,近乎翻倍。此外,在非肿瘤治疗领域,单抗新药的上市成功率更是高达19.3%。尽管在总体上,约有80%-85%的单抗药物会折戟于临床开发阶段,但行业内的成功案例,已足以表明这类药物的潜力。
要勾勒出单抗新药的研发全景,我们有必要了解下它的历史背景。
早期,单抗新药来源于老鼠的免疫接种
——史上首款获批的单抗新药Muromonab-CD3就是如此。由于这些抗体蛋白属于“异种”,它们有着很高的免疫原性。所以当这些单抗进入人体后,会诱使人体产生针对这些抗体的抗体(即人抗鼠抗体)。这些人体内新生的抗体会中和单抗药物,让它们失效。因此,自上世纪80年代以来,人们就开始尝试在抗体序列中提高来源于人体的序列比例,试图降低这些单抗的免疫原性。在这一设想下,
人们开发出了“嵌合抗体”
,即包含了老鼠抗体可变区和人类抗体恒定区的抗体。这固然是一大进步,但人们随后发现,
这些嵌合抗体的免疫原性依然不够低
。
人源化技术的诞生终于让老鼠抗体的免疫原性得到了控制
——通过限制可变区上互补性决定区(即抗原抗体结合的部位)中的鼠类序列,人源化的抗体比嵌合抗体的免疫原性要更低。而全人源的单抗更是完全用人类的遗传信息来编码抗体。尽管没有决定性的证据表明全人源的单抗的免疫原性风险更低,一些观察结果却支持这一论断,很多人也更喜欢这样的抗体。
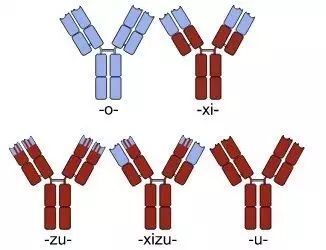
▲
嵌合(右上)、人源化(左下)和全人源(右下)单克隆抗体。人源部分为红色,非人源部分为蓝色。(图片来源:wikipedia)
尽管非完全人源化的抗体依旧将在未来占据重要的一席之地,
全人源的抗体正在变得越来越常见。
自从Humira这首款全人源的单抗在2002年获批以来,
美国FDA已经批准了23款全人源的单抗,占到了市场上所有单抗的40%。
2015年至今,21款单抗中有11款是全人源的抗体。而在2017年获批上市的5款抗体中,更有4款是全人源抗体。这或许也反映了未来单抗发展的趋势。
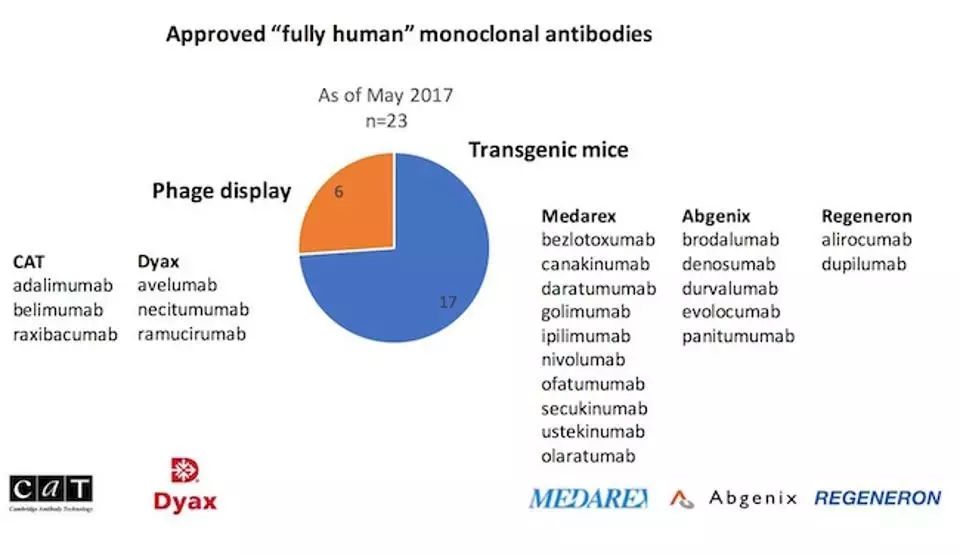
▲
FDA批准的全人源单克隆抗体及其使用的技术(图片来源:福布斯)
从研发手段来看,我们可以从两种常见的方法里获得全人源化的抗体。
第一种方法是小鼠免疫平台,
让小鼠表达人类抗体的可变段、多样段和连接段序列(VDJ antibody sequences),并对它们进行免疫接种;
第二种方法
是“噬菌体展示”
(phage display),在大规模的抗体库中进行筛选。这两种技术平台都各有利弊。对于第一种方法来说,它能利用多样性、表达量与稳定性等体内因素来助力筛选,但它的抗原性可能激发免疫反应,成为一个问题。此外,在研究人员需要进行反向筛选的情况下,这些小鼠也不易构建。而第二种方法则基本上与第一种方法截然相反。
从目前的数据来看,FDA批准的23款全人源抗体中,
有近乎四分之三使用的是小鼠免疫的手段
,其中使用Medarex公司开发的UltiMab技术的获批抗体达到了10款,这包括了重磅免疫疗法药物Nivolumab(商品名Opdivo)。
这一现象可能是由于在研发的过程中,
“噬菌体展示”技术带来的抗体其不确定性更大一些。
2017年,麻省理工学院(MIT)的知名教授Dane Wittrup与同事们发表了一篇详尽的论文,统计了大量抗体在临床研发上的数据,并评估了这些抗体的粘性(自我结合与交叉结合能力)、疏水性、蛋白复合体形成能力、热稳定性、以及重组表达的水平。利用目前已上市的抗体,研究人员制作了一系列“标准曲线”。一旦某一个抗体的数据位于该曲线
最差的10%
范围内,研究人员就为它做一个标记。研究发现,
比起已获批上市的抗体,处于2期临床试验的标记数要多得多
,这很容易理解。在新药研发的过程中,在研药物的一些特性,总是逐渐变得越来越好。然而有趣的是,研究也发现,利用“噬菌体展示”技术带来的抗体,被标记的概率显著高于从哺乳动物体内获取的抗体。
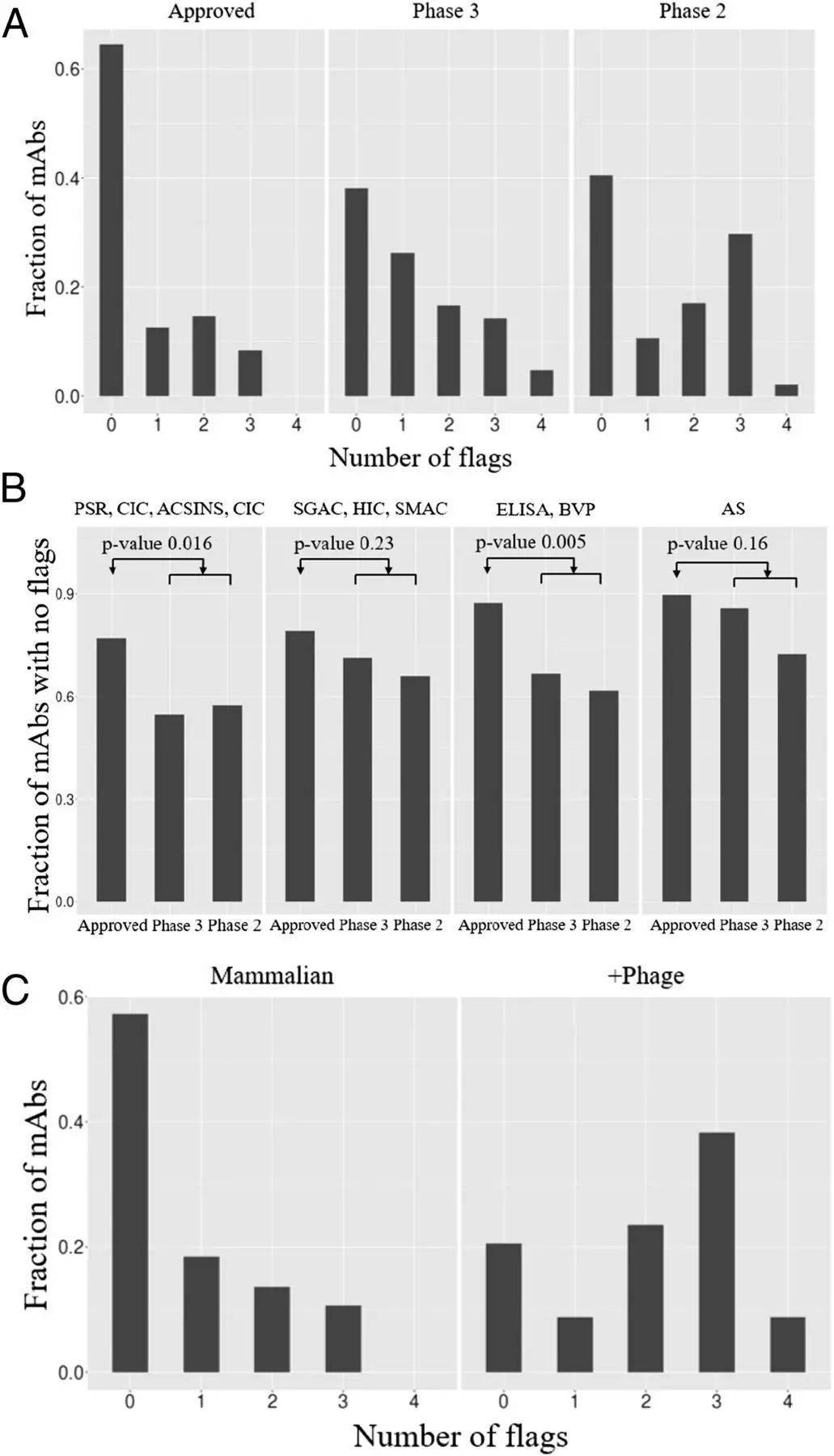
▲抗体研发数据分析(A)根据临床状态分析抗体标志数(B)根据临床进展分析抗体标志数(C)根据技术来源分析抗体标志数(图片来源:PNAS)
但这同样尚无定论。
从新药上市获批的结果上看,这两种方法并没有显著的差异。
2008年,Medarex公司的Nils Lonberg博士(现任百时美施贵宝肿瘤学开发部负责人)撰文,评估了当时位于临床阶段的64款全人源化抗体。如今我们发现,无论是采用动物免疫的手段,还是“噬菌体展示”的手段,
这些抗体的研发成功率都差不多——大约一半的研发项目被终止,四分之一的抗体获批上市,剩下的仍在研发中。
此外,无论是哪一种方法,都已经从实际效果上证实了它的有效性。举例来说,阿斯利康近日获批的抗PD-L1抗体
durvalumab














